| ||||||||||||||||||||||||||||||||
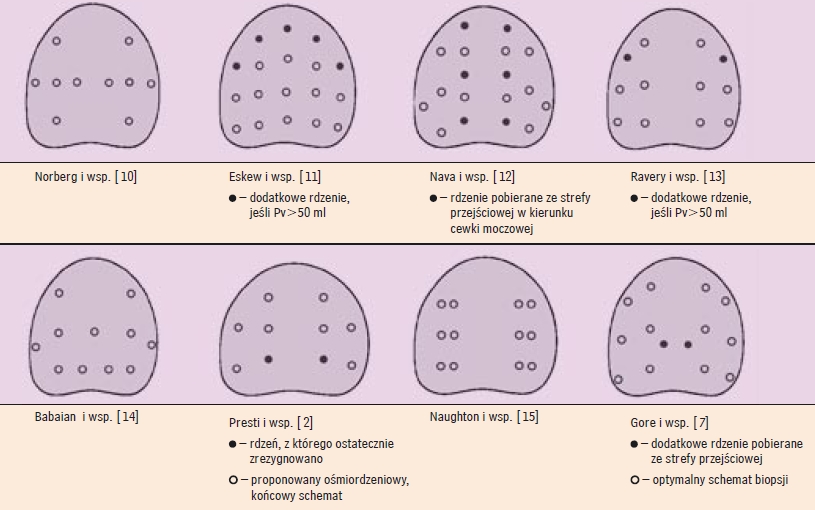
Gęstość wielomiejscowej biopsji "mappingowej" stercza wykonywanej pod kontrolą ultrasonografii przezodbytniczej u mężczyzn, u których podejrzewa się raka jedynie na podstawie podwyższenia stężenia swoistego antygenu sterczowego w surowicyWprowadzenie Rozpoznanie raka stercza (prostate cancer - PCa) u mężczyzn, u których jedyną przesłanką sugerującą istnienie tego nowotworu jest podwyższenie, nawet niewielkiego stopnia, stężenia swoistego antygenu sterczowego w surowicy (serum prostate-specific antigen - s.PSA), opiera się na wielomiejscowej biopsji rdzeniowej gruczołu krokowego wykonanej pod kontrolą ultrasonografii przezodbytniczej (TRUScoreBx), obejmującej pobranie rdzeni tkankowych głównie z obwodowej strefy stercza. Pionierem koncepcji randomowej biopsji tego rodzaju jest Hodge, który w 1989 roku opublikował wyniki badań dotyczących wykrywalności PCa uzyskanej dzięki ujednoliconej biopsji 6-miejscowej (sextant biopsy), polegającej na pobraniu 3 rdzeni tkankowych z prawej i 3 rdzeni z lewej strefy obwodowej. Liczba rdzeni pobieranych w ramach biopsji sekstantowej nie zależy od objętości stercza, i tym samym wydawała się u niektórych mężczyzn zbyt mała. Dlatego schematy TRUScoreBx zaproponowane kolejno przez innych autorów (ryc. 1) obejmują większe liczby rdzeni tkankowych, zwłaszcza w przypadku wyraźnego powiększenia gruczołu krokowego, i uwzględniają pobieranie rdzeni z tych obszarów strefy obwodowej, w których prawdopodobieństwo istnienia PCa jest szczególnie duże - tj. z obszarów bocznych oraz z obszaru okołowierzchołkowego [2, 7, 10-15].
Mnogość zaproponowanych schematów "mappingowej" TRUScoreBx świadczy o tym, że żaden z nich nie spełnia oczekiwań pod względem skuteczności diagnostycznej (tab. 1). Jakkolwiek, niezależnie od tego, że na prawdopodobieństwo uzyskania dodatniego wyniku biopsji (wykrycia PCa) u mężczyzn, u których wynik badania stercza palcem przez odbytnicę (digital rectal examination - DRE) ani TRUS nie sugerują istnienia PCa, wpływa s.PSA oznaczone przed biopsją - prawdopodobieństwo to jest tym większe, im wyższe jest s.PSA [30]; zależy ono także od liczby wycinków pobranych w ramach biopsji oraz od relacji między tą liczbą a objętością stercza [2]. Powszechnie przyjmuje się, że głównym miernikiem warunkującym określenie liczby rdzeni tkankowych pobieranych w czasie "mappingowej" TRUScoreBx jest objętość gruczołu krokowego [16]. Niemniej jednak na całkowitą objętość stercza (proste volume - Pv) składa się zarówno objętość stref środkowej i przejściowej, w których częstość występowania PCa jest znikoma (tylko u 2% chorych, u których wykryto PCa, utkanie nowotworu stwierdzono wyłącznie w obrębie tych stref [19]), jak i objętość stref obwodowych, będących głównie siedliskiem PCa. Wobec tego logiczne wydaje się uzależnienie liczby wycinków pobieranych w ramach "mappingowej" TRUScoreBx od wielkości obwodowej części stercza. Określenie objętości tego fragmentu stercza na podstawie TRUS wykorzystywanej do oznaczenia miejsc pobrania rdzeni tkankowych w czasie biopsji jest kłopotliwe. Jednak określenie pola powierzchni tylnej stercza, będącego pośrednim miernikiem rozległości strefy obwodowej, jest możliwe i znacznie prostsze. Wydaje się przy tym, że grubość strefy obwodowej nie ma istotnego znaczenia, ponieważ nie przekracza ona z reguły długości typowego rdzenia tkankowego pobieranego igłą tru-cut w czasie TRUScoreBx. Cel pracy Opierając się na przedstawionych założeniach, postanowiono
sprawdzić, czy uzależnienie liczby rdzeni tkankowych pobieranych
ze stercza w ramach wielomiejscowej biopsji "mappingowej" od wielkości pola powierzchni strefy obwodowej można uznać za praktycznie przydatne u mężczyzn, u których jedyną przesłanką sugerującą możliwość istnienia PCa jest podwyższenie s.PSA, a także postanowiono zbadać, czy wprowadzenie nowego współczynnika
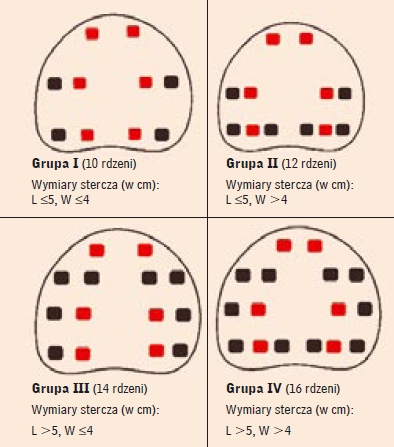
Materiał i metoda Badaniem objęto 116 "kolejnych" mężczyzn w wieku od 51 do 84 lat (wiek średni = 65,4 lat), u których jedynym wskazaniem do wielomiejscowej TRUScoreBx było podwyższenie s.PSA (od >2,5 ng/ml do 10,0 ng/ml); wyniki DRE i TRUS nie nasuwały u nich podejrzenia PCa. Stężenie PSA w surowicy u tych mężczyzn zawarte było w zakresie od 2,74 ng/ml do 9,93 ng/ml (średnia = 7,03 ng/ml), a średnia gęstość PSA (PSAD) wynosiła 0,17 ng/ml/cm3 (od 0,04 ng/ml/cm3 do 1,83 ng/ml/cm3). Mężczyzn podzielono na 4 grupy w zależności od wymiarów (L - długości i W - szerokości) powierzchni tylnej stercza. Liczby rdzeni tkankowych pobieranych w ramach TRUScoreBx uzależniono od rozległości tej powierzchni - schematy biopsji wykonanych u mężczyzn poszczególnych grup przedstawia rycina 2. Gęstość biopsji (TRUScoreBxD) obliczono jako stosunek liczby pobranych rdzeni tkankowych do pola powierzchni tylnej ("odbytniczej") stercza, przy czym kształt tego pola przyrównano do elipsy. Stąd gęstość biopsji obliczono ze wzoru: liczba pobranych rdzeni dzielona przez pole powierzchni elipsy, gdzie oś małą elipsy stanowi szerokość stercza - W, oś wielką długość stercza - L.
Do analizy wpływu gęstości biopsji na wykrywalność raka zastosowano model regresji logitowej. Dla celów analizy regresji zmienną ciągłą skategoryzowano. Punkty odcięcia wyznaczono arbitralnie tak, aby uzyskać kategorie równoliczne. Kategoryzacja gęstości biopsji jako zmiennej ciągłej pozwoliła uniknąć liniowego charakteru zależności. Wprowadzono 3 równoliczne przedziały, ponieważ taka ich liczba jest najmniejszą liczbą pozwalającą zaobserwować inną zależność niż liniowa (zależność między "wykrywalnością" PCa i gęstością biopsji), a jednocześnie umożliwia uzyskanie największej czułości statystycznej. Wyniki PCa wykryto u 32 mężczyzn (28%). Rozkład mężczyzn poddanych biopsji według kolejnych schematów, liczby i odsetki dodatnich wyników TRUScoreBx oraz gęstość biopsji w poszczególnych grupach mężczyzn przedstawia tabela 2.
Stwierdzono istotną statystycznie dodatnią zależność szansy wykrycia PCa od gęstości biopsji - szansa uzyskania dodatniego wyniku TRUScoreBx rośnie wraz ze wzrostem gęstości biopsji. Szansa wykrycia raka dla kwartyla mężczyzn o najwyższej gęstościach biopsji okazała się 3,98 (p=0,003) razy większa niż dla kwartyla mężczyzn, u których gęstość biopsji była najmniejsza. Tabela 3 przedstawia parametry przyjętego modelu regresji logitowej wraz z 95-procentowym przedziałem ufności. Wymowę danych zawartych w tabeli 3 ilustruje rycina 4.
Dyskusja Próbą rozstrzygnięcia zależności między wielkością stercza a adekwatną dla niej liczbą rdzeni tkankowych było wprowadzenie w niniejszym badaniu szczególnego miernika, nazwanego "gęstością biopsji". Przed podjęciem analizy badań mających na celu określenie praktycznego znaczenia tego miernika należy podkreślić wyraźnie, że nie traktujemy tych badań jako podstawy do definitywnego określenia "optymalnych wzorców" TRUScoreBx, które można by proponować do powszechnego stosowania. Opracowując projekt niniejszego studium, zamierzaliśmy jedynie sprawdzić, czy koncepcja, która legła u jego podstaw, jest słuszna. Jej istotą jest - jak wspomniano wcześniej - założenie, że liczba rdzeni tkankowych pobieranych w ramach wielomiejscowej TRUScoreBx w przypadku podejrzenia raka stercza o zaawansowaniu T1c powinna być dostosowana do rozległości strefy obwodowej gruczołu krokowego. Dlatego za podstawę podziału materiału klinicznego na grupy przyjęto tylko dwa wymiary stercza: poprzeczny (szerokość - W) i podłużny (długość - L), a pominięto wymiar przednio-tylny (wysokość - H), zależny głównie od stopnia powiększenia stref środkowej i przejściowej gruczołu krokowego. Uzasadnienie pominięcia wysokości stercza jako przesłanki warunkującej liczbę pobieranych rdzeni tkankowych - wobec tego, że do powstania ogniska lub ognisk pierwotnych PCa dochodzi najczęściej w obrębie strefy obwodowej, a izolowany rak strefy przejściowej lub/i środkowej stercza identyfikowanyjesttylkou2%chorychnatennowotwór[19]-wydaje się mieć racjonalne podstawy; zatem miernikiem odniesienia dla kalkulowania liczby rdzeni tkankowych pobieranych z gruczołu krokowego powinna być wielkość tylnej powierzchni stercza, a nie jego objętość. Jeśli rdzenie tkankowe nie obejmą stref przejściowej i środkowej, "wykrywalność" PCa najprawdopodobniej nie zmniejszy się. W przypadku wzrostu szerokości i długości stercza zwiększa się liczba "kolumn" i "wierszy" ("rzędów") pobieranych rdzeni w kolejnych, zastosowanych w tym badaniu schematach biopsji. Aby równomiernie "bioptować" strefę obwodową stercza, postanowiono rozpoczynać "mapping" od zewnątrz (od obwodu stercza), tzn. od okolicy podtorebkowej i stopniowo przesuwać (pogłębiać) miejsca pobrań w kierunku strefy przejściowej, w której częstość występowania raka jest znacznie mniejsza [20]. Taki sposób pobierania rdzeni tkankowych wykonywanego w projekcji podłużnej zapewnia uzyskanie tkanki ze strefy obwodowej, a kolejne "kolumny" rdzeni tkankowych pobierane bardziej przyśrodkowo przybliżają się do planu "przystrzałkowego" (parasagittal plane), gdzie u części mężczyzn rdzeń tkankowy może objąć tkankę strefy przejściowej (grubość strefy obwodowej w tym miejscu bywa niewielka). Przyjęcie do praktyki klinicznej "mappingu", w którym stała gęstość biopsji wynosiłaby >0,73 rdzenia/cm2 zapewniłoby zapewne zwiększenie wykrywalności PCa oraz przyczyniłoby się do zmniejszenia i skategoryzowania tzw. błędu biopsji (sampling error). Wdrożenie takiej zasady wymagałoby zwiększenia liczby pobieranych rdzeni w każdej grupie badanych. W grupie I pobierano zgodnie z przyjętym schematem 8 rdzeni, średnie pole powierzchni tylnej stercza wynosiło 15,4 cm2, zatem, aby gęstość biopsji przekraczała 0,73/cm2, należałoby pobierać nie mniej niż 11 rdzeni (0,73 x 15,4 = 11,24). Należne liczby średnie wycinków pobieranych w poszczególnych grupach mężczyzn przedstawia tabela 4. Mnogość rdzeni tkankowych pobieranych zgodnie z założeniami, które legły u podstaw koncepcji niniejszego badania, a zwłaszcza estymacja teoretyczna stopnia zwiększenia liczb wycinków, który należałoby zapewnić w celu uzyskania poprawy wykrywalności raka skłania do podjęcia rozważań na temat zaproponowanej przed niespełna 10 laty "biopsji saturacyjnej" (saturation biopsy), polegającej na pobraniu bardzo dużej liczby rdzeni tkankowych z gruczołu krokowego i będącej skrajnym przejawem dążenia do zwiększenia liczby rdzeni tkankowych pobieranych w ramach "mappingowej" TRUScoreBx [21-24]. Niemniej biopsje wykonane według schematów zaproponowanych przez nas dalekie są od spełnienia kryteriów biopsji o takim charakterze. Biopsję tego rodzaju, znacznie bardziej inwazyjną od biopsji mniej rozległych, proponowano wykonywać w przypadku ujemnego wyniku pierwszej biopsji, bowiem stosowanie jej pierwszorazowo [25] nie zwiększa prawdopodobieństwa wykrycia PCa [26, 27]. Ostatecznie uznaje się, że biopsja saturacyjna ma zastosowanie w przypadku podejrzenia PCa, które utrzymuje się po "ujemnej" biopsji wielomiejscowej [28].
Biorąc pod uwagę przedstawione wyżej kalkulacje liczby rdzeni tkankowych pobieranych w ramach wielomiejscowej TRUScoreBx, jeśli wykonuje się ją jedynie z powodu podwyższenia s.PSA, a także uwzględniwszy uwagi na temat biopsji saturacyjnej, należałoby postulować wyznaczenie wielkości referencyjnych gęstości biopsji. Prawdopodobnie należałoby przyjąć inne wielkości (rosnące) dla biopsji pierwszej, drugiej oraz następnych. Kolejnym, nie mniej istotnym elementem dla wykonania TRUScoreBx jest wybór miejsc, z których należy pobrać wycinki ze stercza. Samo przesunięcie linii biopsji sekstantowej (dwurzędowej) z planu przystrzałkowego na bardziej boczny przyczynia się do zwiększenia wykrywalności PCa o 8% [29]. Ponadto udowodniono częstsze występowanie PCa w obszarach bocznych strefy obwodowej, a szczególnie w jej "rogach przednich", podstawie oraz okolicy przywierzchołkowej [18]. Dlatego w badanych przez nas schematach biopsji uwzględniono równomierny "mapping" tych obszarów, zwłaszcza obszarów bocznych, i zdecydowano o zwiększaniu liczby pobieranych rdzeni tkankowych ze strefy obwodowej wraz ze wzrostem szerokości i długości stercza. Wnioski Nowo wprowadzony wyznacznik liczby wycinków, które należy pobrać ze stercza w ramach wielomiejscowej biopsji rdzeniowej wykonanej pod kontrolą ultrasonografii przez odbytniczej wykonanej jedynie z powodu podwyższenia stężenia PSA całkowitego w surowicy - tj. gęstość biopsji - pozwala prowadzić "mapping" stercza ze stałą dokładnością bez względu na wielkość gruczołu krokowego poddanego biopsji. Utrzymanie gęstości biopsji powyżej 0,73 rdzenia tkankowego na 1 cm2 powierzchni tylnej stercza powoduje zwiększenie szansy wykrycia raka prawie 4-krotnie (x 3,98) w porównaniu z gęstością biopsji mniejszą niż 0,59 rdzenia tkankowego na 1 cm2. lek. med. Stanisław Szempliński Piśmiennictwo:
|
||||||||||||||||||||||||||||||||