| ||||||||
Własne doświadczenia wprowadzania programu ERAS u chorych poddanych cystektomii radykalnejSTRESZCZENIE: Cystektomia radykalna (CR) jest najrozleglejszą operacją wykonywaną we współczesnej urologii. Skrócenie czasu hospitalizacji oraz ograniczenie liczby powikłań stanowi wciąż istotne wyzwanie dla ośrodków wykonujących ten zabieg. Wprowadzenie do opieki okołooperacyjnej programu ERAS (Enhanced Recovery After Surgery - pooperacyjna przyspieszona rekonwalescencja) pozwala zarówno skrócić czas hospitalizacji, jak i zmniejszyć odsetek powikłań. Cystektomia radykalna (CR) jest podstawowym sposobem leczeniem chorych na raka pęcherza moczowego naciekającego błonę mięśniową, jak również istotną opcją dla wybranych chorych z rakiem wysokiego ryzyka nienaciekającym błony mięśniowej pęcherza moczowego [1]. W Polsce jest przeprowadzanych ponad 1500 takich zabiegów rocznie [2]. Cystektomia radykalna jest złożoną procedurą chirurgiczną podejmowaną najczęściej u chorych w podeszłym wieku [3], często obciążonych innymi chorobami, spowodowanymi między innymi wieloletnim paleniem papierosów (choroba niedokrwienna serca - POCHP) [4]. Ze względu na szeroki zakres operacji (usunięcie pęcherza wraz ze sterczem lub macicą, rozległą limfadenektomię oraz ingerencję w przewód pokarmowy), zaawansowany wiek i obciążenia dodatkowe częstość powikłań pooperacyjnych jest znaczna; w zależności od doświadczenia ośrodka oraz sposobu raportowania powikłań dotyka od 19% do 64% operowanych chorych [5]. Wśród najczęściej występujących możemy wymienić: zaburzenia czynności przewodu pokarmowego, zakażenia, powikłania związane z raną, powikłania związane z układem moczowym, kardiologiczne i pulmonologiczne (tab. 1). Wczesna śmiertelność pooperacyjna we współczesnych seriach waha się od 0,8% do 8,3% [6]. Aby zmniejszyć częstość wspomnianych wyżej komplikacji, obserwujemy w ostatnich latach stopniową zmianę przygotowania chorych do operacji, prowadzenia znieczulenia, techniki operacyjnej, a także opieki i rehabilitacji pooperacyjnej [7]. Wyrazem takich zmian jest odstąpienie od mechanicznego przygotowania przewodu pokarmowego, zmniejszenie liczby stosowanych antybiotyków i czasu ich podawania, odstąpienie od głodzenia chorego na 2 dni przed operacją, jak również powszechnie dziś akceptowana profilaktyka zakrzepowo-zatorowa w postaci stosowania drobnocząsteczkowych heparyn oraz pończoch uciskowych. W wiodących ośrodkach w celu zmniejszenia urazu operacyjnego wprowadzono dostęp laparoskopowy. Zastosowanie powyższych modyfikacji nie wyeliminowało jednak powikłań, a przebieg pooperacyjny
nierzadko jest ciężki. Często nie koreluje on z zaawansowaniem choroby i przebiegiem śródoperacyjnym (ilością utraconej krwi, czasem trwania operacji). Stąd też poszukujemy dalszych modyfikacji postępowania, które zmniejszą odsetek powikłań oraz przyspieszą okres zdrowienia. Program opieki okołooperacyjnej ERAS (Enchanced Recovery After Surgery), czyli przyspieszona rekonwalescencja po operacji, został zaadaptowany na potrzeby cystektomii radykalnej z chirurgii jelita grubego, gdzie od ponad 10 lat wykorzystuje się jego zalety [8]. Na program ERAS składają się wymienione poniżeń zagadnienia.
W przygotowaniu przedoperacyjnym: 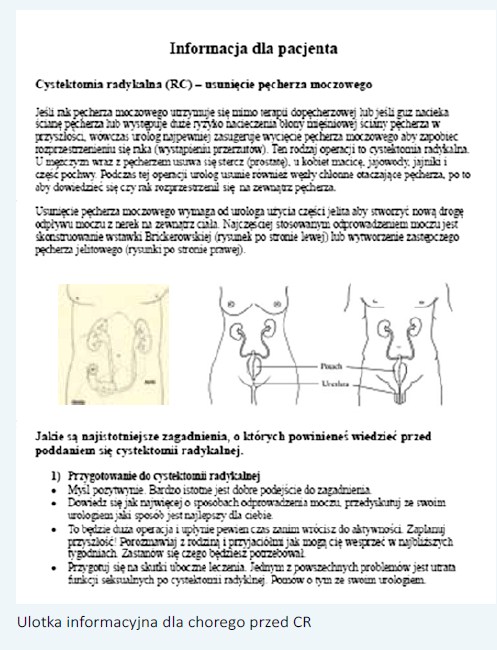 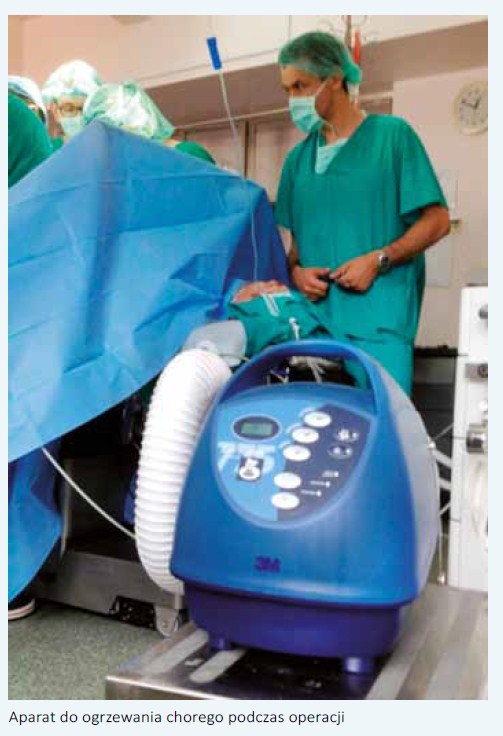
- Zaprzestanie czyszczenia jelit przed CR.
Jeśli chodzi o technikę operacyjną, podnoszone są głosy
co do:
W prowadzeniu opieki pooperacyjnej należy wspomnieć
o: 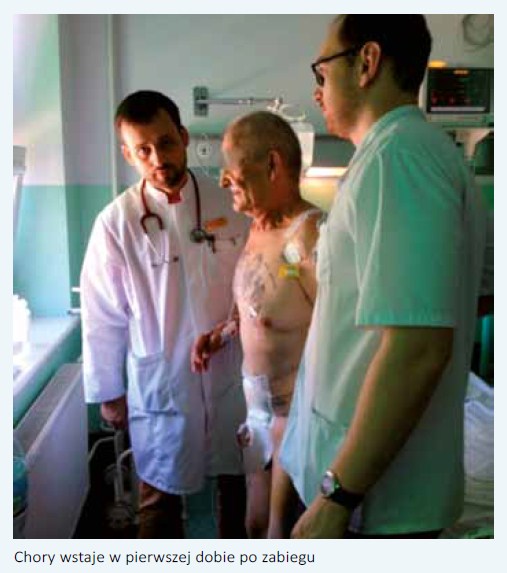  W Klinice Urologii CMKP w Warszawie wraz z kolegami anestezjologami stworzyliśmy zespół, który w sposób szczególny zajmuje się chorymi poddanymi cystektomii radykalnej. Opieka nad tymi pacjentami zaczyna się na kilka tygodni przed planowaną operacją. Podczas pierwszego spotkania urolog przekazuje choremu budujący emocjonalnie przekaz o wspólnej walce z chorobą, dopingujący do podjęcia wysiłku w celu właściwego przygotowania się do operacji. Pozytywne nastawienie pozwoli skrupulatnie wypełnić wszystkie przedoperacyjne zalecenia oraz zmniejszy stres związany z obawą przed operacją. Rozmowa taka może również zmniejszyć sugerowany negatywny wpływ stresu na układ immunologiczny [9]. Jeśli chory zastosuje się do zaleceń i zrezygnuje z palenia co najmniej 30 dni przed CR, poprawi się jego wydolność oddechowa i zmniejszy okołooperacyjna podatność na infekcje dróg oddechowych. Udowodniono, że już 4-tygodniowy okres powstrzymania się od palenia skutkuje poprawą funkcji płuc oraz zwiększa aktywność fagocytarną neutrofili płucnych, to zaś zmniejsza ryzyko pooperacyjnych powikłań oddechowych [10]. Abstynencja alkoholowa również zmniejsza ryzyko powikłań okołooperacyjnych związanych zarówno z zespołem odstawiennym, jak i supresją układu immunologicznego [11]. W celu zwiększenia wydolności fizycznej chory proszony jest o codzienne spacery nie krótsze niż 30 min lub podobnego typu aktywność fizyczną [8]. Ponieważ u chorych niedożywionych poddanych CR ponadtrzykrotnie częściej dochodzi do zgonu w okresie 90 dni od operacji (16,5% vs 5,1%), zalecamy przed CR stosowanie diety wysokobiałkowej, a w tygodniu poprzedzającym zabieg wsparcie jej dietą prze mysłową - Nutridrink [12]. Niezbędne są też specjalistyczne konsultacje przedoperacyjne optymalizujące leczenie nadciśnienia tętniczego, choroby wieńcowej serca, cukrzycy, przewlekłej obturacyjnej choroby płuc czy innych chorób powszechnie występujących u pacjentów poddawanych CR. Czyszczenie jelit należy rozważać jedynie w aspekcie historycznym. Wykazano liczne działania uboczne takiego postępowania. Udowodniono, że mechaniczne czyszczenie jelit zmniejsza stężenie TGF-beta oraz protokolagenu w ścianie jelita, co ma niekorzystny wpływ na wytrzymałość mechaniczną oraz na gojenie się zespolenia. Stres oksydacyjny wywołany przez oczyszczanie upośledza wytrzymałość śluzówki jelita. Skutkuje to powstaniem owrzodzeń na jej powierzchni i translokacją bakterii do węzłów chłonnych. Okazało się również, że obecność naturalnej flory bakteryjnej przyspiesza gojenie zespolenia jelitowego [13]. Przedoperacyjne oczyszczanie jelit prawdopodobnie przyczynia się do wydłużenia czasu niedrożności pooperacyjnej [14]. Ponadto stosowanie tych zabiegów jest równoznaczne z 24-godzinnym przedoperacyjnym głodzeniem oraz może prowadzić do zaburzeń elektrolitowych. Protokół ERAS ma naśladować naturalny rytm funkcjonowania organizmu. Wobec tego nie rezygnuje się z jedzenia i picia przed operacją. Pacjent może spożyć ostatni posiłek składający się z pokarmów stałych jeszcze 6 godzin przed operacją. Wydaje się, że optymalny rodzaj profilaktyki został ustalony i nie pozostaje tematem spornym. Ponieważ CR traktujemy jako operację czystą-zanieczyszczoną (clean-contaminated), zgodnie z zaleceniami Europejskiego Towarzystwa Urologicznego stosujemy pojedynczą dawkę cefalosporyny II lub III generacji nie dłużej niż na godzinę przed rozpoczęciem operacji [15]. Dopełniwszy wszelkich zaleceń okresu przedoperacyjnego, osiągnąwszy optymalny stan zdrowia chorego, urolog przekazuje pacjenta w ręce anestezjologa, który poza premedykacją przedoperacyjną zmniejszającą doznania lękowe powinien pamiętać o kolejnych punktach programu ERAS. Chory powinien dostać 2-3 godziny przed zabiegiem 400 ml wysokoenergetycznego napoju (np. Preop) redukującego poczucie głodu, zmniejszającego stres oraz oporność tkanek na insulinę. Powoduje to zmniejszenie przemiany katabolicznych ustroju, hamuje glukoneogenezę, przyczynia się do zachowania przedoperacyjnej masy mięśniowej, co w rezultacie ułatwia pooperacyjną rehabilitację i przyspiesza powrót do zdrowia [8]. Oprócz techniki operacyjnej i czasu trwania zabiegu na przebieg pooperacyjny wpływa sposób prowadzenia znieczulenia. Jego rodzaj, jak i zastosowane środki mają wpływ zarówno na odczucia bólowe, czas trwania niedrożności pooperacyjnej, jak i na rehabilitację chorego. Najważniejsze wydaje się blokowanie bodźców bólowych z miejsc operowanych, a raczej niedopuszczenie do powstania i przewodzenia bodźców nocyceptywnych [16]. Kompleksowe przeciwdziałanie przewodzeniu tych bodźców uzyskujemy za pomocą znieczulenia zewnątrzoponowego i ta metoda jest preferowana w protokole ERAS. Hipotermia okołooperacyjna, definiowana jako spadek temperatury ciała poniżej 36° C w jakimkolwiek momencie operacji, tuż przed nią lub w okresie pooperacyjnym, jest niedocenianym czynnikiem implikującym wiele powikłań. W znaczący sposób wydłuża pobyt chorego w szpitalu. Do takiego spadku temperatury dochodzi dość łatwo, bo już po 2 godzinach operacji ciało pacjenta ochładza się o 2-4° C. Udowodniono, że u chorego wychłodzonego częściej występują zarówno zakażenia miejsca operowanego, jak i powikłania kardiologiczne. Większa podatność na zakażenia rany chirurgicznej wynika stąd, że hipotermia okołooperacyjna wpływa w znacznym stopniu na układ odpornościowy, upośledzając migrację leukocytów, zdolności żerne neutrofili, a także produkcję cytokin i przeciwciał [17]. Zwiększona skłonność do powikłań sercowo-naczyniowych wynika z faktu, że u wychłodzonego pacjenta wzrasta stężenie katecholamin, dochodzi do obkurczenia naczyń i wzrostu ciśnienia tętniczego krwi. Wzrost oporu naczyniowego skutkuje większym zapotrzebowaniem mięśnia sercowego na tlen i w konsekwencji zwiększa częstość incydentów sercowych [18]. Indukcja znieczulenia ogólnego oraz blokada współczulna wywołana znieczuleniem zewnątrzoponowym powoduje rozkurczenie obwodowych tętniczek przedwłośniczkowych. Zwiększa to objętość łożyska naczyniowego, co powoduje spadek ciśnienie tętniczego krwi. Zazwyczaj zapobiega się temu przez dożylne przetaczanie krystaloidów aż do stabilizacji ciśnienia krwi. Podczas 4-6-godzinnej CR choremu przetacza się 3-5 l krystaloidów, dodatkowo płyny koloidowe, preparaty osocza i masę erytrocytarną. Wielokrotnie w czasie pierwszych kilkunastu godzin pooperacyjnych obserwowaliśmy objawy świadczące o przewodnieniu chorego: poliurię wyrównawczą, obrzęki kończyn dolnych, okolicy lędźwiowej, a nawet duszność spowodowaną zastojem w krążeniu płucnym. Podobny obrzęk występujący w krezce i ścianie jelita może prowadzić do podniedrożności przewodu pokarmowego. Dlatego zastosowanie restrykcyjnej polityki płynowej z jednoczasowym stosowaniem małych dawek amin presyjnych może zmniejszyć wyżej wymienione objawy przewodnienia i przyczynić się do szybszej rekonwalescencji [19]. Technika operacyjna pozostaje zagadnieniem spornym. Logiczne wydaje się, że dostęp laparoskopowy lub robotyczny powinien zmniejszyć uraz wywołany zabiegiem oraz poprawić przebieg pooperacyjny. Technika laparoskopowa powoduje mniejszy uraz operacyjny, co wyraża się między innymi niższym stężeniem uwalnianych cytokin prozapalnych (IL-6, IL-1b) i białka CRP. Jednakże mniejsza inwazyjność przynosi pacjentowi korzyść tak długo, jak zastosowanie laparoskopii nie wydłuża czasu trwania operacji. Przedłużający się czas zabiegu zwiększa bowiem liczbę bodźców nocyceptywnych, które z kolei również zwiększają wydzielanie czynników prozapalnych. Odpowiedź zapalna wydłuża z kolei okres niedrożności pooperacyjnej i sprzyja powstawaniu powikłań [20]. Ponadto w przypadku CR wykonywanej z dostępu laparoskopowego, jak i robotycznego wykorzystuje się połączenie technik mało inwazyjnych stosowanych podczas wycięcia pęcherza moczowego i limfadenektomii z klasyczną techniką wykonania odprowadzenia moczu. Dlatego metody tej nie można nazwać w pełni mało inwazyjną. Za technikami endoskopowymi przemawia mniejsza utrata krwi, szybszy powrót czynności przewodu pokarmowego, który nie przekłada się jednak na krótszą hospitalizację. Plusem dostępu klasycznego jest krótszy czas operacji oraz niższe koszty zabiegu. Wyniki onkologiczne są porównywalne [21]. Dysponujemy niewielką liczbą prac porównujących grupy chorych, u których utrzymywano modelowanie (cewnikowanie) wszczepianych do wstawki lub pęcherza jelitowego moczowodów lub też tych cewników nie pozostawiano. Mattei i wsp. przeprowadzili randomizowane badanie, do którego włączono 37 chorych z wytworzonym pęcherzem jelitowym i 17 z wstawką jelitową. U pacjentów z pierwszej grupy (n=29) usuwano cewniki po 5-10 dniach od operacji, u chorych z drugiej grupy (n=25) usuwano cewniki zaraz po wykonaniu zespolenia moczowodowo-jelitowego. Utrzymanie cewników poprawiało drenaż górnych dróg moczowych, przyspieszało powrót czynności jelit i zmniejszało częstość występowania kwasicy metabolicznej. Nie ustalono jednak optymalnego czasu utrzymywania cewników [22]. W chirurgii kolorektalnej z powodzeniem zrezygnowano ze stosowania drenów, co nie odbiło się na nieszczelności zespolenia czy na ogólnych wynikach leczenia. Czy takie podejście można w sposób prosty przenieść do cystektomii radykalnej- Najpewniej nie. Potencjalne ryzyko zacieku moczu jest większe niż nieszczelności zespolenia jelitowego w chirurgii kolorektalnej. Wydaje się jednak, że możemy pozostawiać dren jedynie w okolicy zespolenia moczowodowo-jelitowego. W pierwszej lub w drugiej dobie pooperacyjnej, po wykluczeniu przecieku moczu (zbliżone do surowicowego stężenie kreatyniny w płynie z drenu), niezależnie od ilości odbieranej przez dren treści należy go usunąć. Usunięcie drenów zmniejsza doznania bólowe i dyskomfort chorego, przyczynia się do szybszej mobilizacji. Odstąpiono od rutynowego utrzymywania sondy żołądkowej z powodu ewidentnego dyskomfortu, który drenaż ten powodował. Utrudniał oddychanie i przełykanie. Dane z dużej metaanalizy nie wykazują korzyści utrzymywania sondy nosowo-żołądkowej po operacji [23]. Należy przypomnieć, że niezależnie od wybranej techniki operacyjnej najważniejszym czynnikiem zmniejszającym liczbę powikłań, a tym samym skracającym czas hospitalizacji jest doświadczenie operującego urologa oraz doświadczenie ośrodka, w którym jest przeprowadzana cystektomia. Udowodniono, że liczba CR wykonywanych przez operatora oraz liczba wykonywanych rozległych zabiegów operacyjnych w danym ośrodku mają bezpośredni wpływ na liczbę powikłań i śmiertelność okołooperacyjną [24]. Jednym z najczęstszych powikłań pooperacyjnych cystektomii radykalnej jest przejściowa podniedrożność przewodu pokarmowego. Powoduje ona opóźnienie wprowadzenia diety doustnej, co w konsekwencji przedłuża hospitalizację. Na podstawie dwóch randomizowanych badań klinicznych udowodniono, że żucie gumy przyspiesza powrót perystaltyki przewodu pokarmowego oraz skraca czas do oddania pierwszych gazów [25]. Kolejnym postępowaniem przyspieszającym zdrowienie chorych jest zapobieganie pooperacyjnym nudnościom i wymiotom. Z jednej strony niewielkie randomizowane badanie udowodniło korzystny efekt dodatkowego śródoperacyjnego przetaczania płynów pod kontrolą przezprzełykowego badania dopplerowskiego [26]. Z drugiej strony następne badanie dotyczące tego samego zagadnienia nie wykazało różnic pomiędzy badanymi grupami. O ile istnieje zgodność, że sednem sprawy jest utrzymanie optymalnego (nie za dużego, nie za małego) przepływu naczyniowego przez przewód pokarmowy, o tyle droga osiągnięcia tego celu pozostaje różna. Jedni badacze sugerują zwiększanie liczby przetaczanych płynów w pierwszej godzinie operacji do 21 ml/kg [26], inni proponują ograniczanie podawania płynów z jednoczesnym stosowaniem amin presyjnych [27], jeszcze inni zalecają podawanie leków inotropowych dodatnich [28]. Brak jednego stanowiska wynika prawdopodobnie z kilku czynników, które wpływają na optymalną perfuzję tkankową - chodzi o wydolność serca, stopień uogólnienia miażdżycy oraz wydolność nerek. Odpowiednie znieczulenie pooperacyjne ma pierwszorzędne znaczenie dla szybkiego powrotu do zdrowia. Zewnątrzoponowe, piersiowe znieczulenie z unikaniem stosowania leków opioidowych pozwala na szybkie uruchomienie chorego, minimalizując ryzyko powikłań płucnych oraz zakrzepowo-zatorowych. Jednocześnie brak stosowania leków narkotycznych dodatkowo przyspiesza powrót funkcji przewodu pokarmowego [29]. Jak dotąd nie opublikowano wpływu stosowania pokarmów doustnych w dniu operacji lub w pierwszej dobie po cystektomii radykalnej na przebieg pooperacyjny. Niemniej udowodniono skrócenie czasu hospitalizacji przy jednoczesnym braku wpływu na inne powikłania u chorych tak żywionych poddanych chirurgii jelita grubego [30]. Ze względu na multidyscyplinarność zespołu ERAS (urolodzy, anestezjolodzy, pielęgniarki, rehabilitanci), kilkudniową opiekę nad chorym oraz wieloetapowość procesu, aby uniknąć nieporozumień i błędów należy rozważyć wypełnianie każdego dnia karty audytu. Jest to dokument przygotowany na każdy kolejny dzień hospitalizacji chorego poddanego CR. Zakłada uśredniony planowany przebieg pooperacyjny i rejestruje odstępstwa od wyżej wymienionych założeń. Karta audytu sugeruje osobom zaangażowanym w opiekę nad chorym, co w kolejnych dniach powinno się z chorym dziać (np. kiedy wprowadzić żucie gumy, kiedy karmienie doustne, kiedy usunąć dren, itp.). Prowadzenie takiej karty wydaje się szczególnie ważne w mniejszych ośrodkach, w których wykonuje się niewiele CR rocznie, oraz w ośrodkach wielospecjalistycznych, w których nie występuje podział na oddziały, a personel średni zajmuje się wszystkimi pacjentami. Obszerny program ERAS wpływa na każdy etap opieki nad chorym - przed zabiegiem, w trakcie cystektomii i w okresie pooperacyjnym. Staranne przestrzeganie całego harmonogramu zwiększa szanse na uniknięcie powikłań, a tym samym na skrócenie czasu hospitalizacji chorego. Wprowadzenie pełnego programu ERAS w Klinice Urologii CMKP było możliwe jedynie dzięki ścisłej współpracy z zespołem anestezjologicznym. Lekarze tej profesji konsultują chorych 2-4 tygodni przed CR, modyfikują lub zalecają modyfikację leczenia chorób współistniejących. Nie bez pewnych oporów przystali na doustne podawanie chorym 2 godziny przed zabiegiem wysokoenergetycznego płynu (Preop). Dzięki modyfikacji ich postępowania zaczęto stosować restrykcyjną politykę płynową z jednoczasowym stosowaniem małych dawek noradrenaliny, jak również wprowadzono ogrzewanie chorych w celu uniknięcia hipotermii. Kolejnym punktem zwrotnym zmiany naszego postępowania było zrezygnowanie z większości drenów. Nie stosujemy sondy żołądkowej, przeważnie nie modelujemy moczowodów (zespalamy je dwuwarstwowo i sprawdzamy szczelność zespolenia), a w jamie otrzewnej pozostawiamy jeden dren. Doświadczonych urologów trudno było również przekonać, aby w pierwszej dobie po CR "postawić chorego na nogi", dać mu pić wodę oraz Nutridrink. Z nie mniejszym zdziwieniem spotkała się chęć usuwania drenu w 2. dobie pooperacyjnej w przypadku, kiedy wciąż odbiera on kilkaset mililitrów klarownej, żółtej treści (robimy tak, jeśli stężenie kreatyniny w drenowanej treści jest zbliżone do stężenia kreatyniny w surowicy). Do nowych trendów udało się przekonać doświadczonych kolegów dopiero wówczas, gdy prowadzeni w ten sposób chorzy błyskawicznie przeszli przez okres pooperacyjny, nie prezentowali powikłań i w 6.-7. dobie pooperacyjnej zostali wypisani do domu.
Nasze doświadczenia prezentowaliśmy na kongresach naukowych w Warszawie w 2015 roku oraz w Budapeszcie. Obecnie prowadzimy badanie prospektywne, randomizowane porównujące oba sposoby opieki okołooperacyjnej u chorych poddawanych CR.
dr n. med. Stanisław Szempliński,FEBU
lek. Michał Skrzypczyk,FEBU
lek. Maciej Oszczudłowski
lek. Bartosz Horosz
dr hab. n. med.Jakub Dobruch Piśmiennictwo:
|
||||||||
