Rak gruczołu krokowego (prostate carcinoma - PCa) jest jednym
z najczęściej występujących nowotworów złośliwych u mężczyzn.
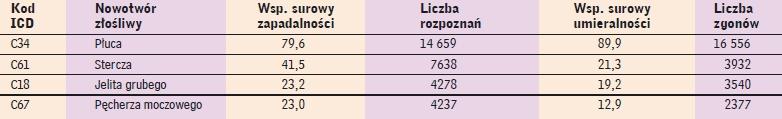
Pod względem zapadalności ustępuje jedynie rakowi płuca (tab. 1).
Stopień zaawansowania PCa w momencie rozpoznania nie jest
w Polsce znany. Niemniej, badania przeprowadzone przed 4 laty [2]
wykazały, że stopień miejscowego zaawansowania klinicznego (cT)
PCa w momencie rozpoznania ustalonego na podstawie wielomiejscowej biopsji rdzeniowej stercza wykonanej pod kontrolą ultrasonografii przezodbytniczej u "kolejnych", pochodzących z różnych
ośrodków urologii mężczyzn poddanych biopsji tego rodzaju z powodu podwyższenia stężenia swoistego antygenu sterczowego
(prostate specific antigen - PSA) w surowicy (serum PSA - s.PSA)
lub/i nieprawidłowego wyniku badania stercza palcem przez odbytnicę (digital rectal examination - DRE) lub/i nieprawidłowego wyniku ultrasonografii przezodbytniczej (transrectal ultrasound - TRUS)
(tab. 2) tylko u niespełna 70% chorych jest niewielki (rak ograniczony do stercza = T1c-T2b, według klasyfikacji TNM z 2009 roku
[3]). U pozostałych stwierdzono raka zaawansowanego miejscowo
(cT32) (tab. 3). Można domniemywać, że u wielu z nich występowały w momencie rozpoznania przerzuty do węzłów chłonnych
(N+) lub/i narządów odległych (M+), głównie kości.
|
Dane epidemiologiczne dotyczące raka stercza na tle innych najczęściej występujących nowotworów złośliwych
u mężczyzn w Polsce w 2007 roku. Według (1) |
 |
|
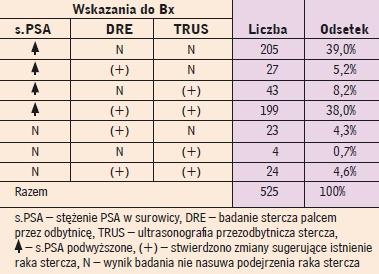
Wskazania do wykonania wielomiejscowej biopsji rdzeniowej stercza pod kontrolą ultrasonografiiprzezodbytniczej z powodu podejrzenia raka u chorych poddanych temu badaniu od połowy 2004 do połowy 2007 roku w Klinice Urologii CMKP (I Zespół
Dydaktyki Urologicznej w Międzyleskim Szpitalu Specjalistycznym). Według (4, 4a) |
 |
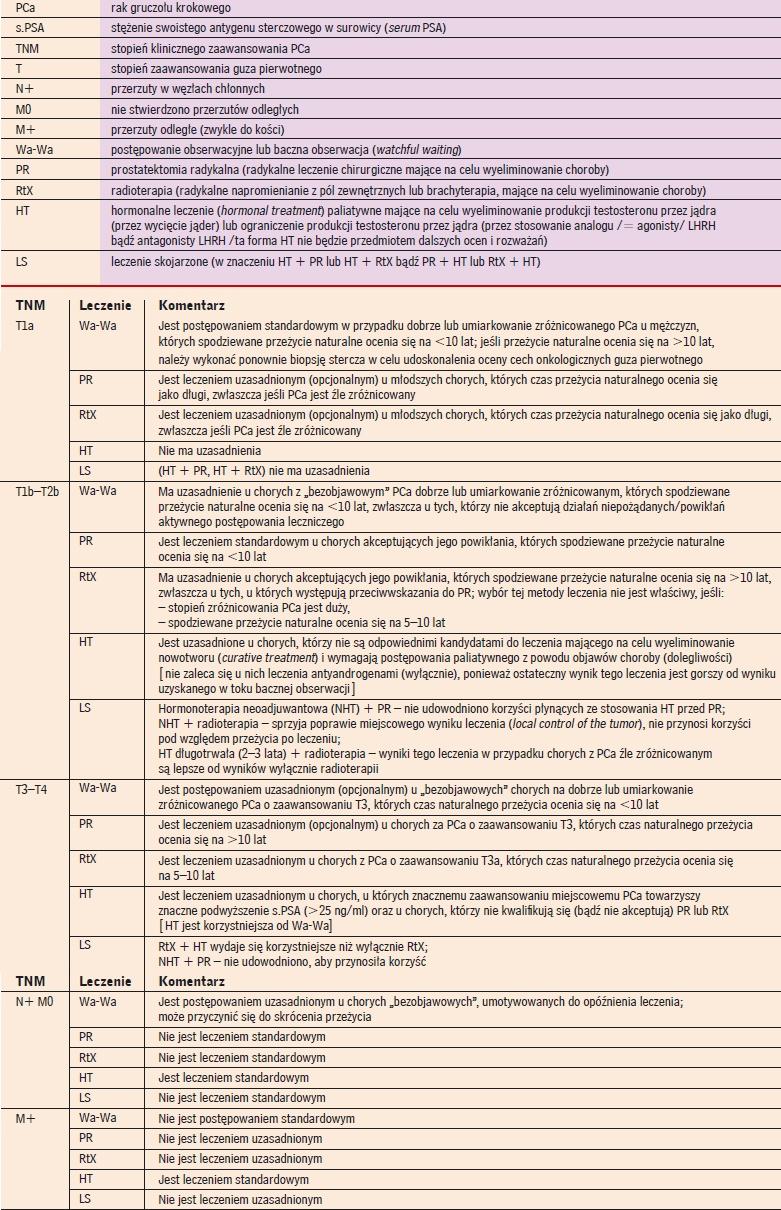
Zasady ogólne leczenia chorych na raka gruczołu krokowego
Zasady leczenia PCa obowiązujące urologów w naszym kraju oparte są na Zaleceniach Europejskiego Towarzystwa Urologicznego (European Association of Urology Guidelines - EAU G-L) zawierających obszerny rozdział poświęcony rakowi stercza [5]. "Zalecenia EAU" odnoszące się do postępowania u chorych na PCa, przyjęte przez Polskie Towarzystwo Urologiczne do stosowania w Polsce przed 10 laty, są niesprzeczne z zaleceniami innych, najpoważniejszych instytucji i towarzystw urologicznych.
W postępowaniu leczniczym u chorych na PCa zastosowanie mają następujące metody:
- Baczna obserwacja (watchful waiting - Wa-Wa), której celem jest opóźnienie leczenia radykalnego zmierzającego
do wyeliminowania raka ograniczonego do stercza, aby dzięki odroczeniu tego leczenia wydłużyć - bez utraty możliwości
wyleczenia chorego - czas, w którym nastąpią potencjalne
powikłania związane z leczeniem radykalnym przyczyniające się do pogorszenia jakości życia leczonych.
- Postępowanie obserwacyjne mające na celu opóźnienie
hormonalnego leczenia paliatywnego, aby dzięki odroczeniu
tego leczenia wydłużyć bezpiecznie czas wolny od powikłań związanych z tym leczeniem.
- Leczenie radykalne w postaci całkowitego wycięcia gruczołu krokowego z pęcherzykami nasiennymi i miednicznymi węzłami chłonnymi (prostatektomia radykalna - PR) lub w postaci
napromieniania z pól zewnętrznych (external beam radiotherapy - EBRT), bądź w postaci napromieniania śródtkankowego
(brachyterapia - BT) polegającego na czasowym wprowadzeniu wysokoenergetycznych źródeł promieniowania do stercza
(high-dose rate brachytherapy - HDR BT) uzupełnionym
nierzadko napromienianiem z pól zewnętrznych, bądź
na wprowadzeniu źródeł promieniowania do stercza na stałe (low-dose rate brachyterapy - LDR).
- Leczenie paliatywne:
- hormonalne - jest leczeniem pierwszego wyboru u chorych
niekwalifikujących się do leczenia radykalnego;
- chemioterapia - ma zastosowanie w przypadku progresji raka
u chorych leczonych hormonalnie, u których PCa "wymyka się" spod kontroli hormonalnej;
- systemowa radioterapia izotopowa - polega na dożylnym
podaniu radioizotopu wykazującego powinowactwo
do komórek raka - ma zastosowanie u wybranych chorych
z przerzutami PCa do kości;
- napromienianie z pól zewnętrznych pozasterczowych ognisk PCa - ma zastosowanie u wybranych chorych z przerzutami odległymi PCa.
|
Stopień klinicznego zaawansowania miejscowego raka stercza u chorych, u których nowotwór rozpoznano na podstawie wielomiejscowej biopsji rdzeniowej wykonanej pod kontrolą ultrasonografiiprzezodbytniczej. Według (2) |
 |
Stosowanie każdej z wymienionych metod leczenia jest uwarunkowane precyzyjnie sformułowanymi wskazaniami. Trzeba podkreślić, że w ostatecznej decyzji odnośnie wyboru odpowiedniej metody leczenia uczestniczy podmiotowo chory, poinformowany przez urologa o istniejących możliwościach terapeutycznych, ich skuteczności, inwazyjności i działaniach niepożądanych. Wskazania do leczenia metodami wchodzącymi w skład wyżej wymienionych grup postępowania terapeutycznego można ująć najogólniej następująco:
- leczenie radykalne ma zastosowanie u chorych na raka
klinicznie ograniczonego do stercza, których czas przeżycia
naturalnego nie jest krótszy niż 10 lat;
- leczenie hormonalne stosuje się u chorych niekwalifikującychsię do leczenia radykalnego;
- chemioterapię systemową stosuje się u chorych, u których
w toku leczenia hormonalnego dochodzi do progresji PCa;
- izotopową radioterapię systemową stosuje się u chorych,
u których w toku leczenia hormonalnego lub chemioterapii
dochodzi do powstania "objawowych" (np. powodujących ból) przerzutów do kości, zaś paliatywne napromienianie
z pól zewnętrznych pozasterczowych ognisk PCa stosuje się
u chorych, u których występują przerzuty odległe niereagujące na leczenie hormonalne lub chemioterapię.
Istnieje kilka postaci leczenia hormonalnego chorych na PCa. Różnice między nimi polegają na liczbie czynników wykorzystanych do oddziaływania na stercz (monoterapia/leczenie skojarzone) oraz czasu ich stosowania. Poszczególne postaci hormonoterapii można ująć następująco:
|
Ogólny zarys leczenia chorych na raka gruczołu krokowego. Według (5) |
 |
A. W zależności od liczby czynników zastosowanych
do ograniczenia/wyeliminowania wpływu testosteronu
na stercz:
-
hormonoterapia jedną metodą - monoterapia:
-
antyandrogenem - lekiem blokującym receptory
dla dihydrotestosteronu
- leczenie prowadzące do zmniejszenia stężenia testosteronu
w surowicy (androgen deprivation therapy - ADT):
-
leczenie polegające na wyeliminowaniu źródła
testosteronu (wycięcie jąder)
- leczenie polegające na zahamowaniu produkcji
testosteronu przez jądra:
-
leczenie analogiem (agonistą) LHRH - lekiem
hamującym produkcję testosteronu przez jądra
wskutek zahamowania wydzielania LH i FSH
przez przysadkę mózgową
- leczenie antagonistą LHRH - lekiem blokującym
receptory LHRH przysadki mózgowej
- hormonoterapia skojarzona:
-
blokada androgenowa minimalna, zwana także obwodową
- blokada androgenowa maksymalna, zwana także całkowitą
- blokada androgenowa supermaksymalna
B. W zależności od czasu zastosowania leczenia:
-
leczenie rozpoczęte niezwłocznie po rozpoznaniu PCa
- leczenie opóźnione
- leczenie ciągłe
- leczenie przerywane
Zasady leczenia chorych na PCa uwzględniające między innymi stopień zaawansowania raka i stopień jego złośliwości określony
w 10-punktowej skali Gleasona (Gleason score - Gl.s.), w której złośliwość dużą (małe zróżnicowanie) oznacza Gl.s. ≥7, a złośliwość małą i umiarkowaną (duże lub umiarkowane zróżnicowanie) oznacza Gl.s. <7, można ogólnie opisać w sposób przedstawiony w tabeli 4.
Leczenie hormonalne chorych na raka gruczołu krokowego
Rak stercza jest nowotworem wykazującym zależność hormonalną, co oznacza, że do jego rozwoju przyczynia się testosteron (T), a właściwie jego biologicznie aktywny metabolit - dihydrotestosteron (DHT), powstający w efekcie redukcji enzymatycznej T powodowanej przez 5α-reduktazę [6]. DHT występuje w sterczu w stężeniu około 10-krotnie większym od stężenia T i wykazuje około 10-krotnie większe powinowactwo do receptorów androgenowych (androgen receptor - AR) [7]. Wobec tego uznaje się, że DHT jest głównym androgenem regulującym rozwój stercza.
Działanie DHT następuje po związaniu się go ze swoistymi receptorami komórki (androgen receptors - ARs).
Zniesienie bądź ograniczenie dostępu androgenów do stercza - przez ograniczenie ich obecności we krwi lub/i zablokowanie ARs, aby nie mogły wiązać DHT i T - prowadzi do zahamowania rozwoju i zmniejszenia rozsiewu PCa [8, 9]. Jakkolwiek, "manipulacje hormonalne" prowadzące do wybitnego zmniejszenia stężenia T
w surowicy (adrogen deprivation therapy - ADT) lub/i zablokowania ARs są podstawą leczenia hormonalnego chorych na PCa, zapoczątkowanego w pierwszej połowie ubiegłego wieku po wykazaniu przez Hugginsa i Hodgesa w 1941 roku wpływu wytrzebienia
na przebieg tego nowotworu [10, 11]. Leczenie hormonalne stosowane początkowo w postaci wytrzebienia chirurgicznego oraz stosowania dwuetylstilbestrolu (DES) podlega stałemu rozwojowi
i doskonaleniu dzięki coraz lepszemu poznaniu uwarunkowań hormonalnych PCa i wprowadzaniu nowych leków pozwalających obniżyć stężenie testosteronu w surowicy lub zablokować receptory androgenowe. Rodzaje leczenia hormonalnego (hormone therapy - HT) stosowanego u chorych na PCa są następujące:
-
HT mająca na celu wyeliminowanie lub ograniczenie czynności hormonotwórczej (produkcja testosteronu) jąder:
-
wytrzebienie chirurgiczne (surgical castration - orchidektomia obustronna),
- wytrzebienie farmakologiczne (medical castration)
przez stosowanie:
-
agonistów/analogów LHRH (buserelina, goserelina,
histerelina, leuprorelina, triptorelina)
- antagonistów LHRH (abareliks, degareliks) - ten sposób
farmakoterapii nie jest powszechnie stosowany i nie będzie przedmiotem dalszych ocen;
- ketokonazolu - ten sposób farmakoterapii ma zastosowanie
w razie konieczności jak najszybszego wyeliminowania
produkcji testosteronu przez jądra bez wycięcia jąder -
ten sposób leczenia stosowany jest wyjątkowo rzadko
i nie będzie przedmiotem dalszych ocen;
- estrogenu w postaci dietylstilbestrolu (DES), leku o charakterze pionierskim w hormonalnym leczeniu chorych na PCa, później zarzuconym wobec stwierdzenia znacznego ryzyka powikłań
ze strony układu sercowo-naczyniowego związanych z jego
stosowaniem, bądź w postaci fosforanu poliestradiolu
do stosowania parenteralnego (co pozwala ominąć bezpośredni dostęp leku do wątroby, występujący po podaniu doustnym)
budzącego ostatnio zainteresowanie - ocena tego sposobu
leczenia wymaga przeprowadzenia kolejnych badań, dlatego również on nie będzie przedmiotem dalszych rozważań;
- HT mająca na celu zahamowanie oddziaływania androgenów krążących we krwi na ich receptory znajdujące się w komórkach stercza (w tym w komórkach PCa), polegająca na stosowaniu
antyandrogenów:
-
niesteroidowych (bikalutamid, flutamid,nilutamid)lub
- steroidowych (octan cyproteronu - CPA, octan megestrolu, octan medroksyprogesteronu).
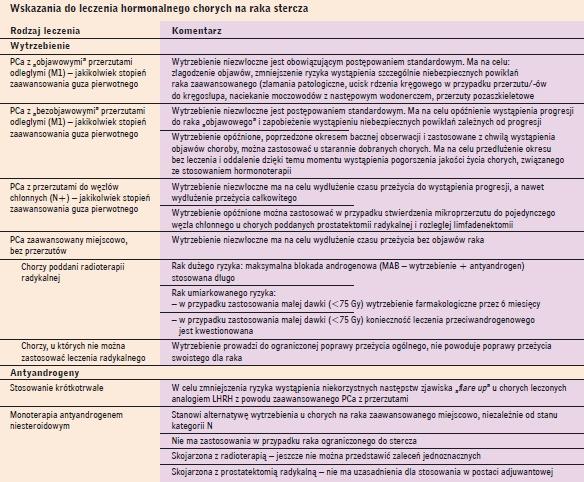
Powszechnie przyjęte wskazania do leczenia hormonalnego przedstawia tabela 5, a przeciwwskazania do takiego leczenia tabela 6.
|
Wskazania do leczenia hormonalnego chorych na raka stercza |
 |
Omówienie poszczególnych form leczenia hormonalnego chorych na raka stercza
Celem wytrzebienia jest wybitne zmniejszenie stężenia T w surowicy (serum testosterone - s.T). Przez wiele lat za wyraz skutecznego działania w aspekcie hormonalnym analogów LHRH stosowanych u chorych na PCa przyjmowano obniżenie s.T do <50 ng/dl. Dzięki wprowadzeniu nowych metod oznaczania s.T, opartych
praktykana chemiluminescencji, stwierdzono, że s.T po wytrzebieniu chirurgicznym jest znacznie mniejsze (średnia = 15 ng/dl [12]). Wobec tego ostatnio sugeruje się, aby za tzw. stężenie kastracyjne (docelowe u leczonych analogiem/agonistą lub antagonistą LHRH uznać s.T wynoszące <20 ng/dl.
|
Przeciwwskazania do różnych form leczenia
hormonalnego chorych na raka stercza |
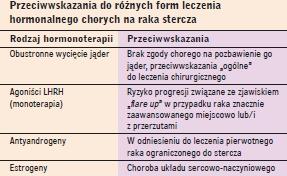 |
|
Analogi LHRH stosowane do leczenia chorych na raka stercza |
 |
Wytrzebienie chirurgiczne
Jest prostym i prawie wolnym od powikłań (można je z powodzeniem przeprowadzić w warunkach znieczulenia miejscowego) sposobem pozwalającym na uzyskanie najszybszego obniżenia s.T
do poziomu "kastracyjnego". Podkreśla się, że zasadniczym czynnikiem powstrzymującym chorych od poddania się tej operacji jest czynnik psychologiczny płynący ze świadomości, że mężczyzna zostaje pozbawiony atrybutu męskości. Jakkolwiek, po obustronnym usunięciu jąder można wszczepić do moszny protezy imitujące ich obecność w mosznie.
Kolejnym czynnikiem ograniczającym wartość orchidektomii obustronnej jest jej "nieodwracalność" - wobec tego nie można jej proponować chorym, u których przewiduje się możliwość stosowania HT przerywanej (intermittent HT).
Analogi LHRH
Analogi syntetyczne LHRH działające długo (buserelina, goserelina, leuprolid, triptorelina) stosowane są do leczenia chorych na zaawansowanego PCa od ponad 15 lat. Stanowią one główną formę leczenia przeciwandrogenowego (androgen deprivation therapy - ADT). Podaje się je w postaci wstrzyknięć lub implantów co 1, 2, 3 lub 6 miesięcy, przy czym czas między podaniem kolejnych porcji leku zależy od dawki (tab. 7).
Analogi LHRH bezpośrednio po podaniu stymulują receptory LHRH przysadki mózgowej i tym samym prowadzą do zwiększenia uwalniania LH i FSH, co przyczynia się do zwiększenia produkcji testosteronu (zjawisko zwane flareup lub testosterone surge) pojawiającego się po upływie 2-3 dni od pierwszego podania analogu
i utrzymującego się przez mniej więcej tydzień. Przewlekłe stosowanie analogu (agonisty) LHRH prowadzi do wyczerpania czynności (down-regulation) receptorów LHRH, co skutkuje ograniczeniem wydzielania LH i FSH i tym samym powoduje zmniejszenie produkcji testosteronu. Stężenie testosteronu w surowicy osiąga tzw. poziom kastracyjny zwykle w ciągu 2-4 tygodni. Niemniej, u około 10% chorych nie dochodzi do zmniejszenia stężenia testosteronu do takiego poziomu (s.T L50 ng/dl) [13, 14, 15].
Główne zastrzeżenie dotyczące stosowania analogów LHRH u chorych na PCa związane jest z nieuniknionym występowaniem zjawiska flareup - przemijający wzrost stężenia testosteronu w surowicy jest niebezpieczny zwłaszcza u chorych na PCa znacznie zaawansowanego miejscowo oraz u chorych z przerzutami do kości - u tych chorych może bowiem dojść w wyniku progresji miejscowej do zupełnego zatrzymania moczu, utrudnienia odpływu moczu z górnych dróg moczowych (jeśli rak nacieka trójkąt pęcherza i obejmuje śródścienne odcinki moczowodów) lub do złamania kompresyjnego kręgów (jeśli przerzuty dotyczą kręgosłupa) z jego ciężkimi następstwami neurologicznymi.
Wystąpieniu niekorzystnych następstw klinicznych zjawiska flareup może zapobiec stosowanie antyandrogenu rozpoczęte co najmniej z chwilą podania analogu LHRH i utrzymywane przez 2 tygodnie. Niemniej u chorych, u których stwierdza się zagrożenie złamaniem kompresyjnym kręgów zmienionych nowotworowo, trzeba zastosować inny sposób leczenia przeciwandrogenowego (androgen deprivation therapy - ADT): orchidektomię obustronną lub podanie antagonisty LHRH (Abarelix - zarejestrowany przez FDA do stosowania jedynie u chorych na "objawowego" PCa z przerzutami, u których nie można zastosować innej formy ADT; Degarelix - w toku badań klinicznych) [5].
Antyandrogeny
Antyandrogeny steroidowe (octan cyproteronu - CPA, octan megestrolu, octan medroksyprogesteronu) lub niesteroidowe, zwane "czystymi" (flutamid, bikalutamid, nilutamid), współzawodniczą kompetycyjnie o miejsce wiązania dihydrotestosteronu w receptorach. Pierwsze z wymienionych, oprócz blokowania miejsc receptorowych dla DHT, mają właściwości progestagenne i wskutek ośrodkowego hamowania przysadki mózgowej przyczyniają się
do zmniejszenia wydzielania LH i FSH, a także powodują supresję funkcji hormonotwórczej nadnerczy. CPA, dzięki jego aktywności progestagennej, stosowany jest z powodzeniem w celu zmniejszenia uderzeń gorąca (hot flushes) występujących po orchiektomii obustronnej [16].
Antyandrogenami niesteroidowymi zarejestrowanymi w Polsce są: flutamidibikalutamid.
Flutamid jest najbardziej popularnym antyandrogenem czystym. Stosuje się go doustnie w dawce dobowej 750 mg. Biologicznie czynny jest metabolit flutamidu-jegoczaspółtrwaniawynosi5-6godzin, wobec tego flutamidpodajesię3razydzienniepo250mg.Wykorzystuje się go do maksymalnej blokady androgenowej (maximal androgen blockade - MAB) wraz z analogiem LHRH oraz
u chorych poddanych orchiektomii. Interesujące jest stosowanie flutamiduw postaci monoterapii - dane zgromadzone dotychczas wydają się świadczyć na korzyść tego sposobu leczenia, jednak wyniki prób klinicznych, z których one pochodzą, nie są w pełni wiarygodne. Niemniej, wątpliwości powinny rozstrzygnąć dane, które przyniesie badanie z randomizacją (flutamidwyłącznievs MAB) prowadzone w Szwecji, obejmujące 700 chorych na PCa [17]. Głównymi
działaniami niepożądanymi flutamidu są biegunka oraz toksyczny wpływ na wątrobę.
Bikalutamid stosowany jest doustnie w dawce dobowej 50 mg w ramach MAB jako uzupełnienie analogu LHRH lub orchiektomii, bądź w postaci monoterapii w dawce dobowej 150 mg (3 x 50 mg), przy czym dawka zwiększona (150 mg) tego leku nie powoduje zmniejszenia jego tolerancji przez chorych. Bikalutamid jako element MAB ma zastosowanie u chorych, którzy źle tolerują flutamid oraz u chorych, u których w toku MAB z udziałem flutamidudochodzi do progresji PCa.
Analiza danych pochodzących z dwóch badań klinicznych przeprowadzonych z randomizacją, w których uczestniczyło prawie 1500 chorych na PCa zaawansowanego miejscowo lub z przerzutami, poddanych monoterapii bikalutamidem w dawce 150 mg dziennie, bądź wytrzebieniu chirurgicznemu lub farmakologicznemu wykazała, że: (i) mediana przeżycia ogólnego chorych z przerzutami poddanych wytrzebieniu było nieco większa (tylko o 6 tygodni) niż chorych poddanych monoterapii bikalutamidem [18], przy czym różnica ta dotyczyła wyłącznie chorych, u których stężenie PSA
w surowicy na początku leczenia było bardzo duże (>400 ng/ml); (ii) różnica między przeżyciem ogólnym chorych bez przerzutów leczonych wyłącznie bikalutamidem oraz chorych poddanych wytrzebieniu okazała się statystycznie nieznamienna (63,5 miesiąca
vs 69,9 miesiąca) [19].
Bikalutamid stosowany w dawce 150 mg dziennie jako leczenie adjuwantowe (następujące po prostatektomii radykalnej lub po radioterapii radykalnej), bądź w przypadku progresji występującej u chorych objętych baczną obserwacją zbadano w ramach trzech różnych prób klinicznych przeprowadzonych z randomizacją (bikalutamid vs placebo) obejmujących łącznie 8113 chorych na raka ograniczonego do stercza lub raka zaawansowanego miejscowo, obserwowanych przez dość długi czas (mediana czasu obserwacji = 3 lata). Wyniki tych badań, ujętych w ramy projektu badawczego zwanego Early Prostate Cancer Programme (EPCP), ujawniły, że stosowanie adjuwantowe bikalutamidu przyczyniło się do zmniejszenia ocenionego obiektywnie ryzyka progresji choroby o 42% [20]. Ocena przeprowadzona po obserwacji, której mediana wyniosła 5,4 lat wykazała, że (i) stosowanie bikalutamidu przyczyniło się do znamiennego wydłużenia czasu przeżycia bez progresji raka oraz że (ii) przeżycie chorych na raka ograniczonego do stercza, u których zastosowano bikalutamid, okazało się krótsze od przeżycia chorych, u których zastosowano placebo [21]. Po jeszcze dłuższym czasie obserwacji (mediana = 7,4 lat) stwierdzono, że stosowanie bikalutamidu u chorych na raka ograniczonego do stercza nie przyczyniło się do przedłużenia czasu przeżycia wolnego od progresji [22]. Trzeba podkreślić, że wysnuwanie jednoznacznych wniosków z EPCP jest trudne z powodu różnorodności materiału klinicznego i postępowania leczniczego w trzech badaniach ujętych zbiorczo w tym programie.
Działania niepożądane bikalutamidu to: ginekomastia (70%), ból piersi (68%). Obydwu tym powikłaniom można zapobiegać stosując antyestrogeny [23] lub napromienianie piersi [24], bądź wykonując mastektomię w przypadku znacznego powiększenia i dużej bolesności piersi.
Konkluzje dotyczące stosowania bikalutamidu u chorych na PCa (wg [5]):
- stosowanie bikalutamidu w dawce 150 mg stanowi alternatywę wytrzebienia u chorych na miejscowo zaawansowanego PCa (bez przerzutów), jeśli celem tego leczenia jest przeżycie
bez progresji choroby oraz u ściśle dobranych chorych na PCa
z przerzutami, u których stężenie PSA w surowicy jest małe [25];
- bikalutamidu nie należy stosować u chorych na raka
ograniczonego do stercza;
- nie potwierdzono, że leczenie bikalutamidem jest pod względem jakości życia chorych korzystniejsze od wytrzebienia;
- korzystny wpływ adjuwantowego leczenia bikalutamidem
chorych poddanych wcześniej leczeniu radykalnemu
(prostatektomia radykalna lub radioterapia radykalna),
a także przewaga leczenia adjuwantowego bikalutamidem
nad leczeniem adjuwantowym polegającym na stosowaniu
analogu LHRH u takich chorych nie został jeszcze potwierdzony.
Porównanie różnych postaci
hormonalnego leczenia chorych na PCa
Minimalna/obwodowa blokada androgenowa (minimal
androgen blockade, peripheral androgen blockade - PAB)
Polega na jednoczasowym stosowaniu finasterydu (leku zmniejszającego stężenie DHT w sterczu dzięki hamowaniu aktywności 5α-reduktazy, enzymu konwertującego testosteron do dihydrotestosteronu - DHT, biologicznie aktywnego metabolitu testosteronu) i antyandrogenu (zapobiegającego wiązaniu pozostałej puli DHT z jego receptorami). W czasie PAB stężenie testosteronu w surowicy pozostaje niezmienione, co sprzyja zachowaniu przez chorych czynności seksualnych i względnie dobrej jakości życia. Na podstawie wyników kilku badań [26-31] można stwierdzić, że PAB jest najbardziej atrakcyjną formą hormonoterapii u chorych, dla których zachowanie jakości życia ma znaczenie zasadnicze, niemniej do czasu uzyskania wyników prób randomizowanych obejmujących odpowiednio duże liczby chorych obserwowanych przez długi czas trzeba je traktować jako leczenie eksperymentalne.
Całkowita/maksymalna blokada androgenowa
(complete androgen blockade - CAB, maximum androgen blockade - MAB)
Polega na połączeniu ADT (orchiektomia obustronna, analog LHRH lub antagonista LHRH) ze stosowaniem antyandrogenu (czystego lub steroidowego).
Wytrzebienie powoduje ogromne obniżenie stężenia testosteronu w surowicy (aż o ≤95%), jednak nie eliminuje całkowicie oddziaływania androgenowego na stercz, wywieranego przez DHT powstający wskutek konwersji w komórkach stercza androgenów pochodzenia nadnerczowego. Dodanie antyandrogenu do wytrzebienia (chirurgicznego lub farmakologicznego) ma na celu zniesienie oddziaływania tej puli DHT na stercz poprzez zablokowanie swoistych receptorów.
Porównanie skuteczności terapeutycznej MAB ze skutecznością monoterapii hormonalnej dokonane na podstawie wielu badań przynosi sprzeczne wyniki [32]. Najnowsze metaanalizy i przeglądy wyników szeregu badań [33-37] wykazały, że skuteczność MAB oceniana pod względem przeżycia jest tylko znikomo większa (<5%) od skuteczności monoterapii. Wobec tego nadal nie ma podstaw, aby rozstrzygnąć, czy tak mała korzyść uzyskiwania dzięki MAB ma rzeczywiste znaczenie dla codziennej praktyki, zwłaszcza że wspomniana poprawa przeżycia ujawnia się dopiero po 5 latach
obserwacji i dotyczy jedynie chorych przyjmujących antyandrogen niesteroidowy w ramach MAB [38]. Należy podkreślić, że odsetek
i nasilenie powikłań (ze strony żołądka i jelit, narządu wzroku oraz układu krwiotwórczego) są większe w przypadku MAB niż w przypadku monoterapii. Ponadto MAB farmakologiczna jest znacznie droższa od monoterapii w postaci orchiektomii.
Leczenie podejmowane natychmiast po rozpoznaniu PCa
i leczenie opóźnione
A. Pierwotne leczenie hormonalne
Raport sporządzony przez Agency for Health Care Policy and Research (AHCPR) wskazuje, że ADT zastosowana wcześnie nie przynosi korzyści pod względem przeżycia w porównaniu z ADT opóźnioną [33, 39]. Przegląd czterech prawidłowo zaplanowanych i przeprowadzonych badań randomizowanych (VACURG I i VACURG II (Veterans Administration Co-operative Urological Research Group) [40, 41], badanie MRC (Medical Research Council) [42] oraz badanie EOCG (Eastern Cooperative Oncology Group) 7887 [43] - wszystkie przeprowadzono przed wprowadzeniem oznaczeń PSA do praktyki klinicznej) wykazał, że wczesna ADT przyczynia się do znamiennego zmniejszenia ryzyka progresji PCa oraz powikłań związanych z progresją, jednak nie powoduje poprawy przeżycia swoistego dla raka i zapewnia tylko względnie małą poprawę przeżycia ogólnego [44].
B. Leczenie hormonalne po leczeniu radykalnym
Prostatektomia radykalna
Poprzednio przyjmowano, że u chorych poddanych prostatektomii radykalnej, u których badanie histopatologiczne węzłów chłonnych wykazało obecność w nich przerzutów (N+) należy zastosować hormonoterapię bezpośrednio po operacji, jednak przed prawie 10 laty, między innymi na podstawie analizy danych zawartych w bazie SEER (Surveillance, Epidemiology and End Results) [45] oraz na podstawie wyników badania EORTC 30891 [46] pogląd ten zakwestionowano, ponieważ wymienione badania dowiodły, że zastosowanie ADT bez zwłoki po operacji u takich chorych przynosi tylko nieznaczną korzyść (w porównaniu z leczeniem opóźnionym) pod względem przeżycia ogólnego, ale nie powoduje zwiększenia przeżycia zależnego od raka.
Z kolei w Zaleceniach ASCO (American Society of Clinical Oncology), opartych na systematycznym przeglądzie literatury, dotyczących leczenia hormonalnego chorych na nawrotowego lub wykazującego cechy progresji androgenowrażliwego raka z przerzutami, zawarto informację, że obecnie nie można jeszcze określić, kiedy należałoby rozpocząć hormonoterapię w przypadku zaawansowanego raka "bezobjawowego" [25] - kwestię tę będzie można rozstrzygnąć
po uzyskaniu odpowiednio przeprowadzonych badań randomizowanych.
Wydaje się, że największą efektywnością kosztową charakteryzuje się hormonoterapia opóźniona, rozpoczęta z chwilą wystąpienia objawów PCa. W odniesieniu do chorych poddanych radioterapii radykalnej z powodu "bezobjawowego" PCa zaawansowanego miejscowo lub regionalnie udowodniono, że stosowanie hormonoterapii
w toku lub/i bezpośrednio po radioterapii skutkuje wydłużeniem czasu do wystąpienia progresji choroby oraz/lub wydłużeniem przeżycia całkowitego w porównaniu z leczeniem opóźnionym wszczętym z chwilą stwierdzenia progresji [47-50].
Leczenie przerywane i leczenie ciągłe
Długotrwałe stosowanie MAB nie jest w stanie wyeliminować wszystkich komórek nowotworowych. Wobec tego po różnie długim czasie (średnio po 24 miesiącach, w którym następuje remisja nowotworu, dochodzi do nawrotu PCa i do uniezależnienia się go od androgenów. Nawrót jest następstwem proliferacji komórek nowotworowych pierwotnie androgenoniezależnych oraz tych, które rozwinęły cechę androgenoniezależności w toku MAB. Wysunięto zatem koncepcję, że przerwanie leczenia hormonalnego przed wystąpieniem progresji związanej z proliferacją androgenoniezależnych komórek raka powinno spowodować ponowne rozwinięcie się zależności raka od androgenów. Koncepcja ta legła u podstaw hormonoterapii przerywanej (intermittent androgen blockade - IAB).
|
Powikłania leczenia hormonalnego chorych na raka stercza |
 |
|
Zalecenia odnośnie stosowania leczenia hormonalnego (HT), w tym także skojarzonego (LS), u chorych na raka gruczołu krokowego, uwzględniające stopień zaawansowania (TNM) nowotworu |
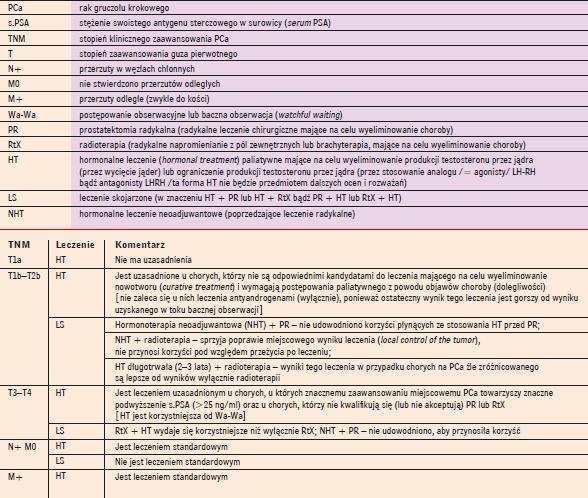 |
Ponadto, IAB stwarza możliwość poprawy jakości życia chorych
w okresach przerw w hormonoterapii i przyczynia się do zmniejszenia kosztów leczenia.
Dotychczas nie zdefiniowano ostatecznie kryteriów doboru chorych do IAB, niemniej chorymi, których można zakwalifikować do leczenia tego rodzaju są ci, u których stwierdza się raka miejscowo zaawansowanego lub nawrót raka [51, 52].
Określono kilka fundamentalnych zasad dotyczących IAB:
-
IAB ma zastosowanie jedynie u chorych, u których
do hormonoterapii wykorzystano wytrzebienie farmakologiczne (MAB lub monoterapia analogiem LHRH).
-
Pierwsza faza leczenia (indukcyjna) powinna trwać
6-9 miesięcy.
-
Leczenie można przerwać, jeśli:
- chory, w pełni poinformowany o jego istocie, jest zdecydowany zastosować się do jego zasad;
- klinicznie nie stwierdza się progresji (wyraźne obniżenie
stężenia PSA w surowicy - na podstawie przesłanek
empirycznych określono je na <4 ng/ml w przypadku raka
z przerzutami i na 0,5 ng/ml w przypadku raka nawrotowego).
-
Od momentu zaprzestania leczenia trzeba objąć chorego
szczególnie dokładną obserwacją (ocena kliniczna i badanie
fizykalne z badaniem stercza palcem przez odbytnicę
oraz oznaczenie s.PSA - zawsze w tym samym laboratorium - co 3-6 miesięcy lub częściej w przypadku większego
zaawansowania raka).
-
Leczenie należy wznowić, jeśli dochodzi do klinicznych
przejawów progresji lub jeśli s.PSA przewyższy poziom
sprzed leczenia (zwykle 4 ng/ml w przypadku PCa
bez przerzutów lub 10-15 ng/ml w przypadku PCa z przerzutami).
- Leczenie - takie samo jak pierwotnie - należy stosować przez
co najmniej 3-6 miesięcy.
- Zasady podejmowania kolejnych cyklów leczenia są takie same, jak podane wyżej - IAB stosuje się do momentu wystąpienia cech hormonooporności PCa.
IAD można już uznać za postępowanie zalecane (nie ma ono charakteru leczenia eksperymentalnego). Obecnie prowadzi się badania nad skutecznością IAB, w której przerwy w hormonoterapii są dłuższe.
Efektywność kosztowa hormonalnego leczenia chorych
na raka stercza
Opublikowano opracowanie (metaanaliza i przegląd piśmiennictwa), w którym dokonano oceny efektywności kosztowej różnych metod ADT (obustronna orchiektomia, leczenie estrogenami, monoterapia analogiem LHRH, monoterapia antyandrogenem, maksymalna blokada androgenowa z udziałem antyandrogenów niesteroidowych) [39]. Ocenę oparto na kalkulacjach, do których wykorzystano skomplikowany model obliczeniowy zastosowany do oszacowania kosztów leczenia przykładowego chorego: mężczyzna 65-letni,
u którego stwierdzono klinicznie jawną wznowę miejscową PCa bez przerzutów odległych, obserwowany przez 20 lat. Ostatecznie stwierdzono, że:
-
najbardziej korzystną z punktu widzenia efektywności kosztowej metodą ADT zapewniającą lepsze przeżycie przy dobrej jakości życia jest obustronna orchiektomia, pod warunkiem, że chory
ją akceptuje;
- MAB jest postępowaniem najmniej korzystnym z ekonomicznego punktu widzenia, przynosi bowiem znikomą korzyść
pod względem zdrowotnym i stwarza największe koszty;
- najlepszą jakość życia i najmniejsze koszty leczenia uzyskuje się, jeśli ADT rozpoczyna się dopiero z chwilą wystąpienia
dolegliwości związanych z istnieniem przerzutów odległych. Ostatecznie można wnosić, że skutecznym sposobem obniżenia kosztów leczenia jest zastosowanie hormonoterapii przerywanej od momentu uzyskania oczywistej klinicznie odpowiedzi na ADT.
Powikłania związane z leczeniem hormonalnym
ADT powoduje szereg powikłań (tab. 8). Niektóre z nich wywierają bardzo niekorzystny wpływ na jakość życia chorych, zwłaszcza młodych, inne zaś przyczyniają się do zwiększenia ryzyka niekorzystnych następstw zdrowotnych związanych z procesem starzenia się chorych. ADT powoduje między innymi upośledzenie czynności seksualnych, dlatego zwłaszcza u młodych chorych chcących zachować aktywność seksualną i tym samym względnie dobrą jakość życia coraz popularniejsza staje się monoterapia antyandrogenem niesteroidowym (np. bikalutamidem), ponieważ pozwala ona na utrzymanie prawidłowego (a nawet wyższego) stężenia testosteronu w surowicy.
Podsumowanie zaleceń dotyczących leczenia hormonalnego chorych na raka stercza (patrz również tab. 9)
- Leczenie hormonalne prowadzące do zniesienia/ograniczenia wpływu androgenów (androgen deprivation therapy - ADT)
na stercz i na raka stercza stosowane u chorych na zaawansowanego PCa przyczynia się do opóźnienia progresji nowotworu,
zapobieżenia ciężkim powikłaniom i skutecznie łagodzi objawy choroby, ale nie powoduje wydłużenia przeżycia chorych.
-
Skuteczność wszystkich form wytrzebienia (np. orchiektomia, analogi LHRH oraz DES) stosowanych w postaci monoterapii (jako leczenie jedyne) u chorych na zaawansowanego PCa
jest podobna.
-
Monoterapia antyandrogenem niesteroidowym
(np. bikalutamidem) stanowi alternatywę wytrzebienia
u chorych na PCa zaawansowanego miejscowo.
-
Stosowanie całkowitej/maksymalnej blokady androgenowej (complete/maximum androgen blockade - CAB/MAB),
polegającej na uzupełnieniu wytrzebienia (chirurgicznego
lub farmakologicznego) leczeniem antyandrogenem niesteroidowym (np. flutamidem), przynosi nie dużą korzyść w odniesieniu do przeżycia całkowitego w porównaniu z wyłącznie ADT,
ale MAB obarczona jest zwiększonym ryzykiem działań
niepożądanych, obniżeniem jakości życia chorych oraz
jest bardziej kosztochłonna niż ADT.
-
ADT przerywaną można już uznać za leczenie uzasadnione,
mimo że nadal oczekujemy danych pochodzących
z długoterminowych badań prospektywnych. Jednak tzw. ADT "minimalną" należy nadal uznawać za leczenie o charakterze eksperymentalnym.
-
Natychmiastowe zastosowanie ADT (wytrzebienie chirurgiczne lub hormonalne zastosowane zaraz po rozpoznaniu choroby)
u chorych na zaawansowanego PCa znacząco zmniejsza progresję choroby, a także odsetek powikłań z nią związanych w porównaniu do ADT opóźnionej (zastosowanej dopiero w momencie
wystąpienia objawów klinicznych progresji). Niemniej, korzyść, którą uzyskuje się dzięki leczeniu zastosowanym bez zwłoki
jest co najwyżej znikoma i nie dotyczy przeżycia zależnego
od raka (cancer-specificsurvival).
-
Orchiektomia obustronna jest najbardziej efektywną kosztowo postacią ADT, zwłaszcza w odniesieniu do chorych na PCa
z przerzutami, u których zastosowano ją po wystąpieniu objawów przerzutów.
prof. dr hab. n. med. Andrzej Borówka
Klinika Urologii Centrum Medycznego Kształcenia Podyplomowego,
I zespół Dydaktyki Urologicznej, Międzyleski Szpital Specjalistyczny w Warszawie
dr n. med. Jakub Dobruch, FEBU
Klinika Urologii Centrum Medycznego Kształcenia Podyplomowego,
I zespół Dydaktyki Urologicznej, Międzyleski Szpital Specjalistyczny w Warszawie
dr hab. n. med. Piotr Chłosta, FEBU, prof. nadzw.
Kliniczny Oddział Urologii Świętokrzyskiego Centrum Onkologii UJK w Kielcach
Piśmiennictwo:
- Krajowy Rejestr Nowotworów. Centrum Onkologii - Instytut im. M. Skłodowskiej-Curie. http://85.128.14.124/krn.
- Dobruch J, Modzelewska E, Popiel M i wsp. Stopień klinicznego zaawansowania raka stercza w momencie rozpoznania. Urol Pol (Pol J Urol) 2006; 59 (4): 269-274.
- Sobin LH, Gospodarowicz M, Wittekind C (eds). TNM classification of malignant tumors. UICC International Union Against Cancer. 7th edn. Wiley-Blackwell, 2009 Dec; str. 243-248.
- Szempliński S. Krytyczna ocena własnego schematu biopsji "mappingowej" stercza u mężczyzn, u których podejrzenie raka stanowi jedynie podwyższenie stężenia PSA w surowicy. Rozprawa doktorska. CMKP, 2010 r.
- Szempliński S, Modzelewska E, Dzik T, Dobruch J, Borówka A. Gęstość wielomiejscowej biopsji stercza wykonywanej pod kontrolą ultrasonografii przezodbytniczej u mężczyzn, u których podejrzewa się raka jedynie na podstawie podwyższenia stężenia swoistego antygenu sterczowego w surowicy. Przegl Urol 2010; 11 (4): 48-51.
- Heidenreich A, Bola M, Joniau S i wsp. European Association of Urology Guidelines on Prostate Cancer. 2010. http://www.uroweb.org/guidelines/online-guidelines/.
- Russell DW, Wilson JD. Steroid 5 alpha-reductase: two genes/two enzymes. Annu Rev Biochem 1994; 63: 25-61.
- Deslypere JP, Young M, Wilson JD i wsp. Testosterone and 5 alpha-dihydrotestosterone interact differently with the androgen receptor to enhance transcription of the MMTV-CAT reporter gene. Mol Cell Endocrinol 1992; 88: 15-22.
- Thompson IM, Goodman PJ, Tangen CM i wsp. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003; 349: 215-24.
- Alberts SR, Blute ML. Chemoprevention for prostatic carcinoma: the role of flutamide in patients with prostatic intraepithelial neoplasia. Urology 2001; 57 (4 Suppl 1): 188-90.
- Huggins C, Hodges CV. Studies on prostate cancer. I. The effect of castration, of estrogen and of androgen injection on serum phosphatase in metastatic caecinoma of the prostate. J Urol 2002; 167 (2P 2): 948-951.
- Huggins C, Stevens RE Jr, Hodges CV. Studies on prostatic cancer. II. The effects of castration on advanced carcinoma of the prostate gland. Arch Surg 1941; 43: 209-23.
- Oefelein MG, Feng A, Scolieri MJ, Ricchiutti D, Resnick MI. Reassessment of the definition of castrate levels of testosterone: implications for clinical decision making. Urology 2000; 56: 1021-1024.
- Sarosdy MF, Schellhammer PF, Soloway MS i wsp. Endocrine effects, efficacy and tolerability of a 10,8-mg depot formulation of goserelin acetate administered every 13 weeks to patients with advanced prostate cancer. BJU Int 1999; 83: 801-806.
- Oefelein MG, Cornum R. Failure to achieve castrate levels of testosterone during luteinizing hormone releasing hormone agonist therapy: the case for monitoring serum testosterone and a treatment decision algorithm. J Urol 2000; 164: 726-729.
- Sharifi R, Browneller R, Leuprolide Study Group. Serum testosterone suppression and potential for agonistic stimulation during chronic treatment with monthly and 3-month depot formulations of gosereline acetate for advanced prostate cancer. J Urol 2002; 168: 1177-1181.
- Eaton AC, McGuire N. Cyproterone acetate in treatment of post-orchiectomy hot flushes. Double-blind cross-over trial. Lancet 1983; 2: 1336-1337.
- Iversen P. Antiandrogen monotherapy: indicationss and results. Urology 2002; 60 (3 Suppl 1): 64-71.
- Tyrell CJ, Kaisary AV, Iversen P i wsp. A randomized comparison of ?Casodex' (bicalutamide) 150 mg monotherapy versus castration in the treatment of metastatic and locally advanced prostate cancer. Eur Urol 1998; 33: 447-456.
- Iversen P, Tyrell CJ, Kaisar AV i wsp. Bicalutamide monotherapy compared with castration in patients with non-metastatic locally advanced prostate cancer: 6,3 years follow up. J Urol 2000; 164: 1579-1582.
- Wirth MP, See WA, McLeod DG i wsp.; Casodex Early Prostate Cancer Trialists' Group. Bicalutamide 150 mg in addition to standard care in patients with localized or locally advanced prostate cancer: results from the second analysis of the early prostate cancer programme at median followup of 5,4 years. J Urol 2004; 172: 1865-1870.
- McLeod DG, Iversen P, See WA i wsp.; Casodex Early Prostate Cancer Trialists' Group. Bicalutamide 150 mg plus standard care vs stabdar care alone for early prostate cancer. JU Int 2006; 97: 247-254.
- Wirth MP, Tyrrell C, Delaere K i wsp. Bicalutamide (Casodex) 150 mg plus standard care in early non-metastatic prostate cancer: results from Early Prostate Cancer Trial 24 at a median 7 yoaers' follow-up. Prostate Cancer Prostatic Dis 2007; 10: 87-93.
- Boccardo F, Rubagotti A, Battaglia M i wsp. Evaluation of tamoxifen and antrazole in the prevention of gynaecomastia and breast pain induced by bicalutamide monotherapy of prostate cancer. J Clin Oncol 2005; 23: 808-815.
- Van Poppel H, Tyrrell CJ, Haustermans K i wsp. Efficacy and tolerability of radiotherapy as treatment for bicalutamide-induced gynaecomastia and breast pain in prostate cancer. Eur Urol 2005; 47: 587-592.
- Loblaw DA, Mendelson S, Talcott JA i wsp. American Society of Clinical Oncology recommendations for the initial hormonal management of androgen-sensitive metastatic, recurrent, or progressive prostate cancer. J Clin Oncol 2004; 22: 2927-2941.
- Fleshner NE, Trachtenberg J. Combination finasteride and flutamide in advanced carcinoma of the prostate: effective therapy with minimal side-effects. J Urol 1995;154:1645-1646.
- Fleshner NE, Fair WR. Anti-androgenic effects of combination finasteride plus flutamide in patients with prostatic carcinoma. Br J Urol 1996;78:907-910.
- Ornstein DK, Rao GS, Johnson B i wsp. Combined finasteride and flutamide therapy in men with advanced prostate cancer. Urology 1996;48:901-905.
- Brufsky A, Fontaine-Rothe P, Berlane K i wsp. Finasteride and flutamide as potency-sparing androgen-ablative therapy for advanced adenocarcinoma of the prostate. Urology 1997;49:913-920.
- Kirby R, Robertson C, Turkes A i wsp. Finasteride in association with either flutamide or goserelin as combination hormonal therapy in patients with stage M1 carcinoma of the prostate gland. International Prostate Health Council (IPHC) Trial Study Group. Prostate 1999;40:105-114.
- Oh WK, Manola J, Bittman L i wsp. Finasteride and flutamide therapy in patients with advanced prostate cancer: response to subsequent castration and long-term follow-up. Urology 2003;62:99-104.
- Moul JW. Twenty years of controversy surrounding combined androgen blockade for advanced prostate cancer. Cancer 2009;115:3376-3378.
- Seidenfeld J, Samson DJ, Aronson N i wsp. Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evidence Report/Technology Assessment No. 4. AHCPR Publication No. 99-E0012, May 1999, Agency for Health Care Policy and Research, Public Health Service, US Department of Health and Human Services, Rockville, MD.
- Prostate Cancer Trialists' Collaborative Group. Maximum androgen blockade in advanced prostate cancer: an overview of the randomized trials. Lancet 2000; 355: 1491-1498.
- Schmitt B, Bennett CL, Seidenfeld J i wsp. Maximal androgen blockade for advanced prostate cancer. Cochrane Database Syst Rev 2000;2:D001526.
- Schmitt B, Wilt TJ, Schellhammer PF i wsp. Combined androgen blockade with non-steroidal antiandrogens for advanced prostate cancer: a systematic review. Urology 2001; 57: 727-732.
- Samson DJ, Seidenfeld J, Schmitt B i wsp. Systematic review and meta-analysis of monotherapy compared with combined androgen blockade for patients with advanced prostate carcinoma. Cancer 2002; 95: 361-376.
- Akaza H, Hinotsu S, Usami M i wsp.; Study Group for the Combined Androgen Blockade Therapy of Prostate Cancer. Combined androgen blockade with bicalutamide for advanced prostate cancer: long-term follow-up of a phase 3, double-blind, randomized study for survival. Cancer 2009;115: 3437-3445.
- Bayoumi AM, Brown AD, Garber AM. Cost-effectiveness of androgen suppression therapies in advanced prostate cancer. J Natl Cancer Inst 2000; 92: 1731-1739.
- Byar DP. Proceedings: the Veterans Administration Co-operative Urological Research Group studies of cancer of the prostate. Cancer 1973; 32: 1126-1130.
- Jordan WP Jr, Blackard CE, Byar DP. Reconsideration of orchiectomy in the treatment of advanced prostatic carcinoma. South Med J 1977; 70: 1411-1413.
- Medical Research Council Prostate Cancer Working Party Investigators Group. Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. Br J Urol 1997; 79: 235-246.
- Messing EM, Manola J, Sarosdy M i wsp. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 1999; 341: 1781-1788.
- Nair B, Wilt T, MacDonald R, Rutks I. Early versus deferred androgen suppression in the treatment of advanced prostatic cancer. Cochrane Database Syst Rev 2002; (1):CD003506.].
- Wong Y, Freedland S, Hudes G i wsp. Androgen deprivation therapy (ADT) for node positive prostate cancer. ASCO Annual Meeting 2007;Part 1;25(18S): abstract 5061.
- Studer UE, Whelan P, Albrecht W i wsp. Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: European Organization for Research and Treatment of Cancer (EORTC) Trial 30891. J Clin Oncol 2006; 24: 1868-1876.
- Granfors T, Modig H, Damber J, Tomic R. Combined orchiectomy and external radiotherapy versus radiotherapy alone for non-metastatic prostate cancer with or without pelvic lymph node involvement: a prospective randomized study. J Urol 1998; 159: 2030-2034.
- Lawton CA, Winter K, Murray K i wsp. Updated results of the phase III Radiation Therapy Oncology Group (RTOG) trial 85-31 evaluating the potential benefit of androgen suppression following standard radiation therapy for unfavorable prognosis carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001; 49: 937-946.
- Bolla M, Collette L, Blank L i wsp. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomized trial. Lancet 2002; 360: 103-106.
- Hanks GE, Pajak TF, Porter A i wsp. Phase III trial of long-term adjuvant androgen deprivation after neoadjuvant hormonal cytoreduction and radiotherapy in locally advanced carcinoma of the prostate: the Radiation Therapy Oncology Group Protocol 92-102. J Clin Oncol 2003; 21: 3972-3978.
- Abrahamsson PA. Potential benefits of intermittent androgen suppression therapy in the treatment of prostate cancer: a systematic review of the literature. Eur Urol 2010; 57: 49-59.
- Boccon-Gibod L, Hammerer P, Madersbacher S i wsp. The role of intermittent androgen deprivation in prostate cancer. BJU Int 2007; 100:738-743.
