| ||||||||||||||||
Zespół bolesnego pęcherza moczowego/śródmiąższowe zapalenie pęcherza moczowegoStreszczenieZespół bolesnego pęcherza moczowego/śródmiąższowe zapalenie pęcherza moczowego (PBS/IC – painful bladder syndrome /IC – intestitial cystitis) należy do przewlekłych schorzeń zapalnych. Zgodnie z definicją Międzynarodowego Towarzystwa Kontynencji (International Continence Society – ICS) PBS jest definiowany jako zespół objawów charakteryzujący się bólem w okolicy nadłonowej w fazie gromadzenia moczu z towarzyszącym częstomoczem i/lub nokturią przy braku lokalnych schorzeń mogących tłumaczyć te objawy. Etiopatogeneza PBS/IC jest wieloczynnikowa i złożona. Opracowano wiele metod terapeutycznych PBS/IC. W artykule przedstawiono epidemiologię, etiopatogenezę, diagnostykę oraz krótkie omówienie poszczególnych terapii mających zastosowanie u pacjentów z PBS/IC. Zespół bolesnego pęcherza moczowego/śródmiąższowe zapalenie pęcherza moczowego (PBS/IC – painful bladder syndrome/IC – intestitial cystitis) należy do przewlekłych schorzeń zapalnych. Zgodnie z definicją Międzynarodowego Towarzystwa Kontynencji (International Continence Society – ICS) PBS jest definiowany jako zespół objawów charakteryzujący się bólem w okolicy nadłonowej w fazie gromadzenia moczu z towarzyszącym częstomoczem i/lub nokturią przy braku lokalnych schorzeń mogących tłumaczyć te objawy (zakażenie układu moczowego, kamica pęcherza moczowego, nowotwór, itd.). ICS zarezerwowało rozpoznanie IC dla pacjentów z typowymi zmianami stwierdzanymi podczas cystoskopii i badania histopatologicznego. W praktyce klinicznej stosuje się rozpoznanie z wykluczenia, tzn. PBS rozpoznaje się po wykluczeniu innych przyczyn dolegliwości bólowych, nawet przy braku typowych objawów dla IC. Zgodnie z zaleceniami ESSIC (European Society for the study of IC/PBS) zespół PBS/IC jest klasyfikowany na podstawie obrazu śluzówki pęcherza moczowego w cystoskopii z hydrodystensją i oceny histopatologicznej wycinków ściany pęcherza moczowego uzyskanych z biopsji. W praktyce klinicznej nasilenie PBS jest opisywane dwoma rodzajami symboli, tj. 1-3 i A-C, korespondującymi odpowiednio z obrazem w cystoskopii i zmianami histopatologicznymi. Symbol X oznacza, że dana procedura nie została wykonana (tab. 1).
Epidemiologia PBS/ICWyniki badań epidemiologicznych nad częstością występowania PBS/IC są różne, co wydaje się być spowodowane niestosowaniem jednolitej klasyfikacji PBS/ IC. Ostatnie doniesienia wykazują ogólnie wyższą częstość występowania PBS/IC w stosunku do lat ubiegłych, a zakres waha się od 0,06% do 30%. U kobiet PBS/IC jest stwierdzany znacznie częściej niż u mężczyzn (10:1). Częstość występowania PBS/IC wynosi 52–500/100 tys. u kobiet w porównaniu z 8–41/100 tys. u mężczyzn, a zapadalność jest szacowana na 1,2/100 tys. Warto zauważyć, że częstość występowania PBS/IC wzrasta do 1431/100 tys. u kobiet, które mają krewnego pierwszego stopnia z PBS/IC, co może sugerować podłoże dziedziczne. Chociaż PBS/IC częściej diagnozuje się w wieku średnim, może też występować u dzieci i niemowląt. Częstość występowania PBS/IC w populacji dzieci jest nieznana. Zgodnie z kryteriami NIDDK (National Institute of Diabetes and Digestive and Kidney Diseases) rozpoznanie PBS/IC jest wykluczone u pacjentów poniżej 18. roku życia. Dowody wskazują, że około 25% osób dorosłych, u których zdiagnozowano PBS/IC, zgłasza ciągłość lub progresję objawów od dzieciństwa. Etiopatogeneza PBS/ICPatofizjologia PBS/IC jest słabo poznana, ponieważ nie ma zgodności dotyczącej definicji i klasyfikacji tego schorzenia. Istnieje wiele teorii tłumaczących rozwój PBS/IC (ryc. 1, tab. 2). Koncepcja zapalenia neurogennego i aktywacji mastocytów Liczne badania histologiczne ściany pęcherza moczowego u pacjentów z PBS/IC wykazały odczyn zapalny w obrębie całej ściany pęcherza moczowego, cechujący się naciekami komórek tucznych (mastocytów) oraz zwiększoną ilością limfocytów w okolicach aferentnych zakończeń nerwowych. Komórki tuczne są wielofunkcyjnymi komórkami układu immunologicznego, które zawierają w swoich ziarnistościach bardzo silne mediatory stanu zapalnego, takie jak histamina, leukotrieny, serotonina i liczne cytokiny. Wiele objawów klinicznych (ból, częstomocz) oraz morfologicznych (obrzęk, włóknienie i neoangiogeneza w blaszce właściwej błony śluzowej pęcherza moczowego) jest prawdopodobnie związanych z nadmierną aktywnością komórek tucznych i uwalnianiem mediatorów stanu zapalnego. Badania Bouchelouche i wsp. wykazały zwiększoną ilość leukotrienu E4 i eozynofilowego białka X oraz tzw. nacieki mięśnia wypieracza przez komórki tuczne u pacjentów z IC. Uwalnianie z czuciowych zakończeń nerwowych prozapalnych neuropeptydów, takich jak substancja P i peptyd kodowany genem kalcytoniny (calcitonin gene-related peptide – CGRP), inicjuje rozwój zapalenia neurogennego, na które składa się głównie poszerzenie naczyń krwionośnych i obrzęk okolicznych tkanek. Ponadto dochodzi do aktywacji zapalnych komórek jednojądrzastych i mastocytów, co pociąga za sobą nasilenie procesu zapalnego. Zwiększenie czułości (proces sensytyzacji) aferentnych zakończeń nerwowych grupy C na szereg bodźców działających na urotelium prowadzi do wzmożonej aktywacji tych włókien, a nasilona lokalna efektorowa czynność tych włókien do rozwoju tzw. zapalenia neurogennego. U pacjentów z PBS stwierdzono wybitny wzrost immunoreaktywności hydroksylazy tyrozynowej w tkance pęcherza moczowego. Może to być interpretowane jako oznaka zwiększonej aktywności komponenty współczulnej autonomicznego układu nerwowego, która wspiera koncepcję neurogenną patogenezy PBS/IC.Dysfunkcja urotelium/uszkodzenie warstwy glikozaminoglikanów Nabłonek urotelialny pęcherza moczowego jest pokryty warstwą glikozaminoglikanów (GAG), która pełni funkcję ochronną, zapobiegając przyleganiu drobnoustrojów i resorpcji składników moczu do ściany pęcherza moczowego. Uszkodzenie tej warstwy zostało uznane za jedną z przyczyn objawów PBC/IC. Badanie przeprowadzone przez Ericksona i wsp. nie wykazało różnicy w poziomie GAG i kwasu hialuronowego u pacjentów zdrowych i z PBS/IC. Jednakże Lokeshwar i wsp. wykazali zależność między stopniem nasilenia objawów i zwiększonym poziomem GAG w moczu. Wiadomo, że pacjentów z PBS/IC cechuje zwiększona przepuszczalność urotelium na skutek zmniejszonej ilości ścisłych połączeń i białek adhezyjnych. Fakt ten ułatwia przenikanie jonów potasu do blaszki właściwej błony śluzowej, przyczyniając się do wystąpienia objawów typowych dla PBS/IC.Białko Tamm-Horsfalla/metabolizm tlenku azotu Ostatnie doniesienia wykazały, że ilość białka Tamm- -Horsfalla jest różna u pacjentów z BPS w porównaniu z osobami zdrowymi. Białko to jest syntetyzowane w nerkach i może odgrywać rolę w obronie immunologicznej, a co za tym idzie w zapobieganiu uszkodzeniu komórek urotelialnych przez szkodliwe składniki moczu. Ponadto zmiana aktywności syntazy tlenku azotu (NOS) może być istotna dla odpowiedzi immunologicznej w przebiegu PBS/IC. Doustna podaż L-argininy, substratu dla syntezy tlenku azotu, prowadzi do zwiększonej ilości metabolitów NO w moczu pacjentów z PBS.Mechanizm autoimmunologiczny przeciwjądrowych (antinuclear antibodies – ANA) u pacjentów z PBS/IC sugeruje patomechanizm autoimmunologiczny rozwoju PBS/IC. Krążące immunoglobuliny IgA, IgG i IgM, które mogą łączyć się z urotelium, opisano już w 1970 roku. Pacjentów z IC cechuje większa ilość limfocytów T CD8+ i CD4+, limfocytów B, plazmocytów oraz immunoglobulin w porównaniu z osobami zdrowymi.Czynnik antyproliferacyjny Dysfunkcja nabłonka urotelialnego pęcherza moczowego może być związana z produkcją substancji podobnych do epidermalnego czynnika wzrostu (epidermal growth factor – EGF) wiążącego heparynę. Wykazano, że pacjenci z PBS/IC różnią się nie tylko pod względem ilości produkowanych czynników wzrostu, lecz także szybkości proliferacji i wytwarzania czynnika antyproliferacyjnego (anti-proliferative factor – APF) w porównaniu z osobami zdrowymi. Mechanizm upośledzonego tworzenia komórek urotelialnych może obejmować zarówno hamowanie genów stymulujących proliferację, jak i aktywację genów hamujących wzrost komórek.Zakażenie Żaden drobnoustrój nigdy nie został uznany za przyczynę PBS. U pacjentek z objawami typowymi dla PBS Warren i wsp. wykazali udokumentowane zakażenie jedynie w niewielu przypadkach. Domingue i wsp. opisali obecność genów kodujących 16S r RNA bakterii w ścianie pęcherza moczowego u 29% pacjentów z PBS/IC. Nie zostało to jednak udowodnione w innych badaniach. Możliwość udziału drobnoustrojów w patogenezie PBS/IC nadal pozostaje bez odpowiedzi.Predyspozycja genetyczna Dorosłe kobiety będące krewnymi pierwszego stopnia pacjentów z PBS/IC cechuje 17-krotnie większa częstość występowania PBS/IC w porównaniu do populacji ogólnej. Dodatkowo w tej samej grupie pacjentów odnotowano większą zgodność z wystąpieniem PBS/ IC wśród bliźniąt jednojajowych w porównaniu do dwujajowych.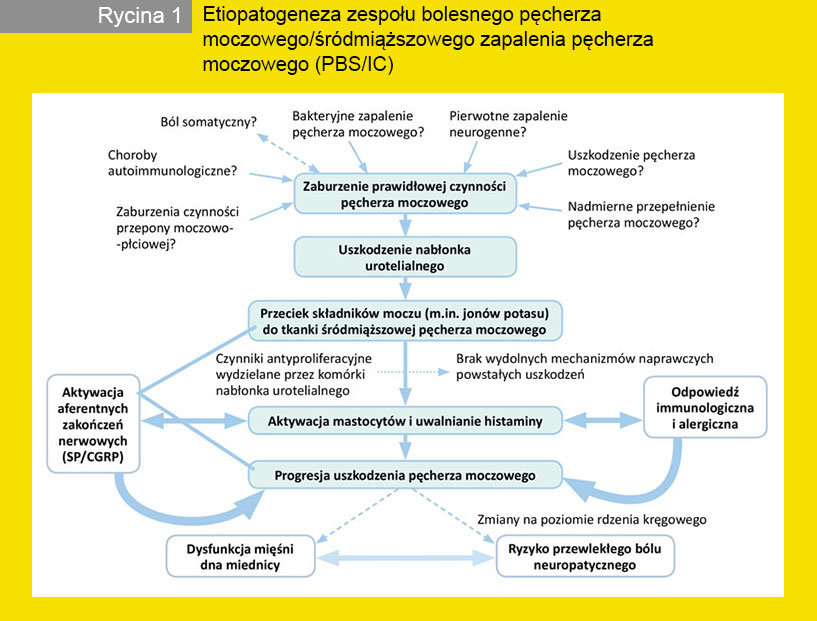
Inne Ostatnie doniesienia wskazują na udział receptorów tachykinowych (NK1 i NK2), bradykininowych (BK1), kanabinolowych (CB1 i CB2) oraz muskarynowych (M3-M5) w patogenezie PBS/IC.Rozpoznanie PBS/ICZgodnie z zaleceniami Europejskiego Towarzystwa Badań nad PBS/IC rozpoznanie PBS/IC oparte jest na stwierdzeniu następujących objawów: 1) ból w obrębie miednicy trwający dłużej niż 6 miesięcy, 2) uczucie ucisku lub dyskomfort z towarzyszącym co najmniej jednym innym objawem ze strony dolnych dróg moczowych, tj. parcie naglące lub częstomocz. Ponadto, zanim zostanie postawione rozpoznanie PBS/IC, powinny być wykluczone typowe schorzenia prowadzące do wystąpienia podobnych objawów. Dokładna analiza objawów jest niezmiernie ważna w grupie pacjentów zgłaszających dyskomfort w obrębie miednicy mniejszej, częstomocz i parcia naglące. Zazwyczaj pacjenci z PBS/IC zgłaszają ból pęcherza moczowego w fazie gromadzenia moczu, który ustępuje po mikcji. Należy pamiętać o wzajemnych relacjach nadaktywnego pęcherza moczowego (overactive bladder – OAB) i zespołu bolesnego pęcherza moczowego (PBS) (ryc. 2). U 14% pacjentów z IC stwierdza się nadreaktywność mięśnia wypieracza pęcherza moczowego (detrusor overactivity – DO) w badaniu urodynamicznym. Dokładne badanie fizykalne powinno wykluczyć między innymi zapalenie pochwy, zmiany w obrębie sromu, uchyłek cewki moczowej, itd. Badania wstępne powinny obejmować badanie ogólne moczu z posiewem moczu. U pacjentów z krwiomoczem uretrocystoskopia z cytologią moczu powinna być obowiązkowa w celu wykluczenia nowotworu. Zgodnie z zaleceniami Europejskiego Towarzystwa Urologicznego algorytm diagnostyczny podkreśla znaczenie cystoskopii z hydrodystensją i biopsji pęcherza moczowego. W 1914 roku Hunner jako pierwszy opisał typowe zmiany w cystoskopii jako zmiany zapalne z glomerulacjami. Warto zauważyć, że zmiany opisane przez Hunnera dzieli się na dwie podkategorie – niewrzodziejące i wrzodziejące. Zmiany wrzodziejące związane są z silniejszym bólem w obrębie miednicy i parciem naglącym. Biopsja ściany pęcherza moczowego uzupełnia diagnostykę różnicową objawów typowych dla PBS/IC o ocenę w kierunku raka in situ (CIS) lub zapalenia pęcherza moczowego na podłożu gruźliczym. Ponadto dokładne określenie typu PBS jest niezbędne, aby uniknąć ewentualnych powikłań ze strony górnych dróg moczowych w przebiegu PBS typ 3C. Typ ten cechuje intensywny proces zapalny toczący się w obrębie pęcherza moczowego, prowadzący do nasilonego włóknienia i rozwoju niskopojemnościowego zwłókniałego pęcherza moczowego oraz, ewentualnie, uropatii zaporowej na skutek uciśnięcia śródściennych odcinków moczowodów. Należy podkreślić, że pacjenci z PBS/IC częściej chorują na alergie, astmę, chorobę Leśniowskiego-Crohna, fibromialgię, toczeń rumieniowaty, zespół jelita drażliwego, wulwodynię, migrenowe bóle głowy, itd. Leczenie PBS/ICOpisano wiele algorytmów leczenia PBS/IC. Terapie te podzielono na: 1) behawioralne/dietetyczne, 2) farmakoterapię, 3) terapię dopęcherzową, 4) leczenie zabiegowe, 5) leczenie operacyjne. Dotychczas opisano ponad 180 sposobów leczenia PBS/IC o różnej skuteczności. Według najnowszych wytycznych najbardziej uznane terapie PBS/IC obejmują: 1) farmakoterapię (hydroksyzyna, amitryptylina, polisiarczan pentozanu sodu) oraz 2) terapię dopęcherzową (polisiarczan pentozanu sodu, DMSO, toksyna botulinowa w połączeniu z hydrodystensją) (tab. 3). Poniżej przedstawiono krótkie omówienie poszczególnych terapii, mających zastosowanie w leczeniu pacjentów z PBS/IC.
Leczenie niefarmakologiczne Terapia behawioralna jest korzystna dla kontrolowania takich objawów, jak częstomocz, parcia naglące i obejmuje kontrolę godzin mikcji, trening pęcherza moczowego oraz kontrolę ilości przyjmowanych płynów. Zmniejszenie poziomu ogólnego stresu jest związane ze zmniejszeniem poziomu odczuwanego bólu i epizodów parcia naglącego u pacjentów z PBS/IC. W zmniejszaniu częstości występowania objawów typowych dla PBS/IC rolę może odgrywać również unikanie kofeiny, ostrych potraw i napojów gazowanych. Fizjoterapia może być skuteczna w leczeniu zaburzeń układu moczowo-płciowego i odbytu. Biofeedback i masaż tkanek miękkich może stymulować rozluźnienie mięśni dna miednicy, w konsekwencji łagodząc objawy. Trening pęcherza moczowego w połączeniu z technikami behawioralnymi jest atrakcyjny dla pacjentów z PBS/IC i dominującymi objawami, takimi jak częstomocz i parcia naglące bez istotnych klinicznie dolegliwości bólowych. Parsons i wsp. wykazali na grupie 21 pacjentów z BPS, u których stopniowo wydłużano okresy pomiędzy mikcjami, znamienne 50% zmniejszenie epizodów parć naglących, częstomoczu i nokturii (n=15) oraz umiarkowany wzrost pojemności pęcherza moczowego. Również Chaiken i wsp. dokonali retrospektywnej analizy na grupie 42 pacjentów, którzy byli pouczeni o kontroli ilości przyjmowanych płynów, świadomym wydłużaniu okresów pomiędzy mikcjami oraz zostali poddani treningowi pęcherza moczowego i mięśni dna miednicy. Wyniki pokazały, że po 12 tygodniach okresy pomiędzy mikcjami wydłużyły się średnio o 93 minuty, a liczba mikcji w ciągu dnia spadła do średnio 9. Ogólnie 88% pacjentów zgłosiło znamienne złagodzenie objawów po zastosowanej terapii behawioralnej.Farmakoterapia Istnieje wiele opcji farmakoterapii, mimo to wiele z nich nie daje satysfakcjonujących efektów.Hydroksyzyna Hydroksyzyna jest antagonistą receptora histaminowego H1, który blokuje aktywację komórek tucznych poprzez hamowanie sekrecji serotoniny między innymi z zakończeń nerwowych. Dawka początkowa wynosi 25 mg (przed snem), zwiększana do 50 mg/dzień lub, jeśli jest dobrze tolerowana, do 75 mg. Najczęstsze działania niepożądane to senność i ogólne osłabienie, które zwykle ustępują po okresie leczenia. Hydroksyzyna zmniejsza nasilenie objawów u ponad 90% pacjentów.Amitryptylina Należy do grupy trójpierścieniowych leków przeciwdepresyjnych. Łagodzi objawy BPS/IC. Mechanizm działania polega na blokowaniu receptorów dla acetylocholiny, hamowaniu zwrotnego wychwytu serotoniny i noradrenaliny oraz na blokowaniu receptorów histaminowych H1. Ponadto ma działanie przeciwlękowe. Terapia rozpoczyna się od stopniowego zwiększania dawki w odstępach 1-tygodniowych o 25 mg do maksymalnej dawki dobowej na poziomie 100 mg. Amitryptylina znacznie zmniejsza dolegliwości typowe dla PBS/IC (parcia naglące, ból), natomiast nieznamiennie zmniejsza częstomocz i zwiększa pojemność pęcherza moczowego. Główne działania niepożądane, związane z własnościami antycholinergicznymi (suchość w jamie ustnej, itd.), są przyczyną zaprzestania terapii.Polisiarczan pentosanu sodu (PPS, Elmiron) Jako syntetyczny polisacharyd jest stosowany do zmniejszania przepuszczalności nabłonka urotelialnego dróg moczowych, zastępując uszkodzone glikozaminoglikany. Terapia PPS wykazała subiektywną poprawę w bólu, parciu naglącym i częstomoczu w porównaniu do grupy kontrolnej. Inne wieloośrodkowe badanie wykazało, że PPS był skuteczniejszy u pacjentów z typowymi zmianami w pęcherzu moczowym charakterystycznymi dla PBS/IC. Dłuższy czas terapii był związany z większym odsetkiem dobrej odpowiedzi (ponad 50% pacjentów cechowała poprawa po 26 tygodniach terapii). Typowa dawka to 150–200 mg (2 x dziennie), jakkolwiek wchłanianie ze światła przewodu pokarmowego nie jest całkowite. Główne działania niepożądane stwierdzane podczas terapii to: zaburzenia żołądkowo-jelitowe, bóle głowy, zmęczenie (częstość występowania: 1–80%). U pacjentów słabo reagujących na monoterapię PPS dołączenie heparyny (podskórnie) wykazało lepszą odpowiedź na terapię skojarzoną.Leki przeciwbólowe Ból jest często dominującym objawem w przebiegu PBS/IC, dlatego wielu pacjentów stosuje różne środki przeciwbólowe na każdym etapie choroby. Jednak ból ten ma charakter bólu trzewnego, a nie somatycznego, zatem słabo reaguje na typowe leczenie analgetyczne. Krótko działające opioidy mogą być wskazane w przypadku okresowych zaostrzeń choroby. Stosowanie długo działających opioidów jest możliwe po wyczerpaniu wszystkich innych dostępnych metod farmakoterapii.Sterydy Z uwagi na wiele poważnych działań ubocznych przewlekłej sterydoterapii leki te nie są zalecane. Sterydoterapia powinna zostać rozważona u pacjentów z wrzodziejącą postacią PBS/IC, niereagującą na inne leki.Leki antyalergiczne Antagoniści receptorów histaminowych H1 i H2 wpływają na aktywność mastocytów, mimo to efekty tych terapii są niespójne.Antybiotyki Mają ograniczoną rolę w terapii PBS/IC.Leki immunosupresyjne W grupie 38 pacjentów z PBS/IC terapia azatiopryną w dawce 50–100 mg/dzień skutkowała ustąpieniem dolegliwości bólowych i częstomoczem odpowiednio w 22 i 20 przypadkach. Inne badanie porównujące skuteczność Cyklosporyny A (1,5 mg/kg, 2 x dziennie) i PPS (3 x 100 mg) przez 6 miesięcy wykazało wyższość Cyklosporyny A nad PPS w zmniejszaniu częstomoczu oraz w całkowitej odpowiedzi na terapię (75% vs 19%). Cyklosporyna A miała zdecydowanie więcej działań niepożądanych (nadmierne owłosienie, ból i przerost dziąseł, parestezje kończyn, ból brzucha, zaczerwienienie, bóle mięśniowe, drgawki). Podczas stosowania Cyklosporyny A obowiązkowe jest częste kontrolowanie ciśnienia tętniczego krwi i parametrów nerkowych.Gabapentyna Jako lek przeciwdrgawkowy znajduje zastosowanie w terapii zespołów bólowych. Stosowanie gabapentyny zmniejsza zapotrzebowanie na opioidy.Farmakoterapia o ograniczonej skuteczności Cymetydyna Jako antagonista receptora histaminowego H2 poprawia objawy PBS/IC. Po 3 miesiącach terapii obserwowano zmniejszenie bólu i nokturii, jakkolwiek obraz histologiczny śluzówki pęcherza moczowego nie uległ zmianie.Prostaglandyny Misoprostol (600 μg/dzień przez 3 miesiące) zmniejszał dolegliwości u części pacjentów PBS/IC. Niemniej działania niepożądane wystąpiły w 64% przypadków.L-arginina Opisano korzystny efekt doustnej terapii L-argininą (substratem dla syntazy tlenku azotu) w redukcji objawów u pacjentów z PBS/IC.Terapia dopęcherzowa Dopęcherzowe stosowanie leków pozwala osiągnąć wyższe stężenie leku w miejscu docelowym z ograniczoną ilością ogólnoustrojowych działań niepożądanych. Wadą tej metody jest konieczność cewnikowania pęcherza moczowego, które może być bolesne u pacjentów z BPS/IC.Środki miejscowo znieczulające Istnieją sporadyczne doniesienia o skuteczności dopęcherzowych instylacji lignokainy w leczeniu PBS/IC. Alkalizacja roztworu lignokainy poprawia jej farmakokinetykę. Znaczące, natychmiastowe złagodzenie objawów obserwowano u 94% pacjentów, w tym u 80% efekt utrzymywał się przez ponad 2 tygodnie po wlewce dopęcherzowej roztworu lignokainy (40000 U heparyny, 2% lidokainy (160 mg) i 3 ml 8,4% wodorowęglanu sodu).Polisiarczan pentosanu sodu (PPS). PPS, jako glikoproteina uzupełniająca warstwę GAG, jest stosowany również dopęcherzowo z powodu niskiej biodostępności po podaniu doustnym. W badaniu na grupie 20 pacjentów (10 – podaż PPS, 10 – placebo) dopęcherzowa podaż PPS (300 mg w 50 ml 0,9% NaCl, 2 x w tygodniu przez 3 miesiące) łagodziła objawy u 4 pacjentów (w grupie PPS) i u 2 pacjentów (w grupie placebo). Pojemność pęcherza moczowego wzrosła po dopęcherzowych wlewkach PPS. Po 18 miesiącach objawy były mniej nasilone u 8 pacjentów kontynuujących terapię PPS i u 4 pacjentów bez terapii PPS. Heparyna. Heparyna została zaproponowana jako czynnik powlekający. Dopęcherzowe instylacje roztworu heparyny (10 000 U heparyny w 10 ml 0,9% NaCl, 3 x w tygodniu przez 3 miesiące) prowadziły do zmniejszenia objawów i poprawy przez ponad 12 miesięcy po terapii. Kwas hialuronowy. Jest naturalnym proteoglikanem przydatnym w naprawie uszkodzeń w warstwie glikozaminoglikanów. W grupie 25 pacjentów pozytywną odpowiedź na kwas hialuronowy obserwowano u 56% po 4 tygodniach i u 71% po 7 tygodniach. Po upływie 24 tygodni skuteczność terapii zmniejszyła się. Nie obserwowano znaczącej toksyczności terapii. Siarczan chondroityny. Dopęcherzowa podaż siarczanu chondroityny wykazała korzystne działanie u pacjentów z dodatnim wynikiem testu stymulacji potasem. W badaniach Steinhoffa i wsp. na grupie 18 pacjentów leczonych dopęcherzowymi wlewkami 40 ml siarczanu chondroityny (1 x/tydzień przez 4 tygodnie, a następnie 1 x/miesiąc przez 12 miesięcy) 13 pacjentów ukończyło całą terapię. W tym 12 pacjentów odpowiedziało na terapię w okresie 3–12 tygodni. W 6/13 przypadków (46,2%) odpowiedź na leczenie była dobra, w 6/13 (46,2%) częściowa, a w 1/13 (7,7%) brak było pozytywnej odpowiedzi. DMSO. Dimetylosulfotlenek (DMSO) jest chemicznym rozpuszczalnikiem rozpuszczalnym w wodzie, który przenika przez błony komórkowe. Wykazujedziałanie przeciwbólowe, przeciwzapalne, kolagenolityczne oraz zwiotczające mięśnie. Jest także środkiem zmiatającym wolne rodniki tlenowe (m.in. rodnik OH), który uważany jest za istotny czynnik etiologiczny procesu zapalnego. Po przetestowaniu DMSO stwierdzono empirycznie, iż łagodzi objawy u pacjentów z BPS/IC. Terapia przy użyciu DMSO należy do standardowych terapii. W jednym z badań klinicznych na grupie 33 pacjentów otrzymujących wlewki dopęcherzowe z 50% roztworu DMSO lub wlewki placebo (0,9% NaCl) w schemacie czterech sesji (2-krotne wlewki co 2 tygodnie) subiektywną poprawę odnotowano u 53% pacjentów otrzymujących DMSO w porównaniu z 18% otrzymujących placebo. Obiektywną poprawę po podaży DMSO lub placebo stwierdzono odpowiednio w 93% i 35% przypadkach. Podaż DMSO jest przeciwwskazana w przypadku zakażenia układu moczowego oraz krótko po biopsji ściany pęcherza moczowego. Długoterminowy efekt DMSO może być stwierdzany nawet po upływie 16–72 miesięcy u wybranych chorych. DMSO powoduje wystąpienie tymczasowego nieprzyjemnego zapachu z ust o woni czosnku. Opisano przypadek odkładania się nadmiaru barwnika w tęczówkach po zastosowaniu DMSO, dlatego podczas terapii DMSO wskazana jest kontrola okulistyczna. BCG terapia. Nie znajduje rutynowego zastosowania w terapii BPS/IC. Waniloidy. Waniloidy (kapsaicyna, resiniferotoksyna) modulują (desensytyzują) aferentne włókna nerwowe grupy C za pośrednictwem między innymi receptorów waniloidowych TRPV1. Dzięki temu zmniejszają nasilenie procesu zapalnego na podłożu neurogennym, który jest istotny w rozwoju PBS/ IC. Podaż resiniferotoksyny zmniejsza częstomocz, nokturię i nasilenie dolegliwości bólowych. Ponadto zwiększa pojemność cystometryczną pęcherza moczowego. Najczęstszym działaniem niepożądanym podczas instylacji resiniferotoksyny jest ból pęcherza moczowego (u ponad 80% pacjentów). Leczenie zabiegowe Hydrodystensja pęcherza moczowegoPolega na rozciąganiu ścian pęcherza moczowego w czasie cystoskopii poprzez podawanie większej ilości płynu niż czynnościowa pojemność pęcherza moczowego pacjenta z PBS/IC. Badanie Eriksona i wsp. wykazało, że hydrodystensja pęcherza moczowego prowadzi do zmniejszenia stopnia nasilenia objawów u pacjentów z nowo rozpoznanym PBS/IC, jakkolwiek kilku pacjentów miało poprawę o co najmniej 30%. Wykazano, że hydrodystensja poprawia normalizację poziomu czynnika antyproliferacyjnego i czynników podobnych do epidermalnego czynnika wzrostu wiążącego heparynę w moczu, jakkolwiek mechanizm zmniejszania nasilenia objawów w reakcji na rozciąganie ścian pęcherza moczowego pozostaje nieznany. Hydrodystensja pęcherza moczowego jest powszechną metodą leczniczą PBS/IC, mimo to naukowe uzasadnienie jej skuteczności jest niewystarczające. Stanowi również dobre narzędzie diagnostyczne PBS/IC. Technologia EMDA (Electromotive Drug Administration) Technologia ta znalazła również zastosowanie w leczeniu PBS/IC. Pozwala na lepszą penetrację leku w formie zjonizowanej dzięki jonoforezie. W przypadku terapii dopęcherzowej anoda jest wprowadzona do pęcherza moczowego przez cewkę moczową, natomiast katodę stanowi elektroda przezpowłokowa w okolicy nadłonowej.Przezcewkowa elektroresekcja/koagulacja zmian w pęcherzu moczowym Zabiegi endoskopowe mają na celu usunięcie wrzodów Hunnera. Liczne badania wskazują, iż usuwając typowe zmiany makroskopowe dla PBS/IC umożliwiamy złagodzenie dolegliwości ze strony dolnych dróg moczowych w większości przypadków.Toksyna botulinowa BTX-A Toksyna botulinowa ma działanie antynocyceptywne na aferentne zakończenia nerwowe pęcherza moczowego, dzięki czemu prowadzi do zmniejszenia objawów i poprawy parametrów urodynamicznych. W grupie 13 pacjentów z BPS ostrzyknięto podśluzówkowo ściany i trójkąt pęcherza moczowego (w 20–30 miejscach) toksyną BTX-A w dawce 100–200 IU, co prowadziło do subiektywnej poprawy w 69% przypadków. Obserwowano znamienne zmniejszenie częstomoczu, nokturii i dolegliwości bólowych oraz zwiększenie pojemności cystometrycznej i pojemności pęcherza, przy której odczuwano pierwszą chęć oddania moczu (first desire to void – FD). Ponadto w randomizowanym badaniu klinicznym porównywano skuteczność dwóch terapii, tj. 1) hydrodystensji i 2) hydrodystensji z dopęcherzową terapią toksyną BTX-A. Spośród 67 pacjentów 44 zostało podzielonych na dwie podgrupy: jedna otrzymała 200 IU, a druga 100 IU BTX-A z hydrodystensją pęcherza moczowego po 2 tygodniach od ostrzyknięcia. Pozostali pacjenci zostali poddani tylko hydrodystensji (n=23). Wyniki wskazały zmniejszenie nasilenia objawów we wszystkich grupach. Natomiast w grupie tylko po hydrodystensji ponad 70% pacjentów prezentowało nawrót objawów do 4 tygodni,podczas gdy w grupach dodatkowo po terapii BTX- -A obserwowano pozytywny efekt po 3 miesiącach (mniejszy ból, większą czynnościową i cystometryczną pojemność pęcherza moczowego). Po 12 i 24 miesiącach pozytywne efekty stwierdzano w grupach poddanych terapii skojarzonej lub samej hydrodystensji, odpowiednio w 55% i 30% vs 26% i 17%.Terapia hiperbaryczna (hyperbaric oxygen – HBO) Wyniki prospektywnego badania sugerują, że terapia hiperbaryczna jest bezpieczna i stanowi nową metodę leczniczą wykazującą umiarkowaną skuteczność u małej grupy pacjentów z PBS.Neuromodulacja Badanie prospektywne na grupie 22 pacjentów z PBS poddanych neuromodulacji nerwów krzyżowych (sacral nerve stimulation – SNS) lub sromowych (pudendal nerve stimulation – PNS) wykazało znamienną poprawę u 59% pacjentów po PNS i u 44% po SNS.Leczenie operacyjne W przypadku gdy wszystkie wyżej opisane metody nie są skuteczne w złagodzeniu uporczywych objawów PBS/IC, leczenie operacyjne, polegające na usunięciu zmienionego chorobowo pęcherza, pozostaje rozwiązaniem ostatecznym. Opisano 3 typowe postępowania, tj. 1) cystektomię z pozostawieniem trójkąta pęcherza moczowego, 2) resekcję trójkąta pęcherza moczowego i 3) cystektomię radykalną z uretrektomią.PodsumowanieWieloczynnikowa i złożona etiopatogeneza PBS/IC czyni tę jednostkę chorobową trudnym problemem diagnostyczno-terapeutycznym w urologii. Postawienie rozpoznania przez wykluczenie innych potencjalnych przyczyn objawów typowych dla PBS/IC jest kluczowe. Leczenie PBS/IC jest wielokierunkowe i obejmuje wiele metod o różnej skuteczności.
dr n. med.Kajetan Juszczak, FEBU
dr n. med.Piotr Maciukiewicz Piśmiennictwo u autorów: kajus@amwaw.onet.pl |
||||||||||||||||
