| ||||||||||||||||||||||||||||||
Kamica moczowa - Wytyczne European Association of UrologyRozpowszechnienie, etiologia, ryzyko nawrotu, klasyfikacja, diagnostyka 1.1. Rozpowszechnienie, etiologia, ryzyko nawrotu1.1.1. WstępZachorowalność na kamicę moczową zależy od czynników geograficznych, klimatycznych, etnicznych, żywieniowych i genetycznych. Ryzyko wystąpienia nawrotu kamicy jest określone przez chorobę lub zaburzenie powodujące powstawanie kamienia. W nawiązaniu do tego wskaźniki rozpowszechnienia kamieni moczowych wahają się od 1% do 20% [9]. W krajach o wysokim standardzie życia, takich jak Szwecja, Kanada czy USA, częstość występowania kamieni nerkowych jest szczególnie wysoka (>10%). Na niektórych obszarach odnotowano wzrost częstości występowania o ponad 37% w ciągu ostatnich 20 lat [10] (tab. 1.1.1).
Kamienie mogą być spowodowane przez zakażenie lub przez przyczyny niezakaźne (kamienie infekcyjne i nieinfekcyjne), wady genetyczne [13] albo działanie niepożądane leków (kamienie lekowe) (tab. 1.1.2).
1.1.2. Skład kamieniZnajomość składu kamieni jest podstawą do podejmowania dalszych decyzji diagnostycznych i postępowania terapeutycznego. Kamienie często tworzą się z mieszaniny substancji. W tabeli 1.1.3 podano klinicznie najistotniejsze substancje i ich składniki mineralne.
1.1.3. Czynniki ryzyka powstawania kamieniCzynniki ryzyka powstawania kamieni mają szczególne znaczenie, ponieważ określają prawdopodobieństwo nawrotu lub odrastania kamieni, a ich poznanie jest niezbędne do wdrożenia leczenia farmakologicznego. Około 50% czynników powstawania kamieni nawraca tylko raz w życiu [11, 14]. Choroby o wysokim wskaźniku nawrotów obserwuje się u nieco ponad 10% pacjentów. Rodzaj kamienia i ciężkość przebiegu choroby określają niskie lub wysokie ryzyko nawrotu (tab. 1.1.4) [15, 16].
1.2. Klasyfikacja kamieniKamienie moczowe mogą być klasyfikowane w zależności od wielkości, położenia, właściwości względem promieniowania rentgenowskiego, etiologii powstawania, składu oraz ryzyka nawrotu [11, 26-28]. 1.2.1. Rozmiar kamieniWielkość kamieni jest zwykle podawana w jednym lub dwóch wymiarach. Pomiary sklasyfikowano według największej średnicy: do 5 mm, 5-10 mm, 10-20 mm i >20 mm. 1.2.2. Lokalizacja kamieniKamienie mogą być klasyfikowane według położenia anatomicznego: górny, środkowy i dolny kielich; miedniczka nerkowa; górny, środkowy i dystalny odcinek moczowodu; pęcherz moczowy. Leczenie kamieni pęcherza nie zostało omówione. 1.2.3. Właściwości kamieni w promieniowaniu rentgenowskimKamienie mogą być klasyfikowane na podstawie rentgenowskiego zdjęcia przeglądowego (tab. 1.2.1) w zależności od składu mineralnego [28]. Tomografia komputerowa bez kontrastu może zostać wykorzystana do klasyfikacji kamieni według gęstości, struktury wewnętrznej i składu, co może wpływać na decyzje dotyczące leczenia [27-28].
Podział kamieni w zależności od etiologii, składu i ryzyka nawrotu znajduje się w podrozdziale 1.1. 1.3. Diagnostyka1.3.1. Diagnostyka obrazowaObraz kliniczny informuje o najodpowiedniejszej metodzie obrazowania, która różni się w przypadku podejrzenia kamienia moczowodu lub podejrzenia kamienia nerkowego. Standardowa ocena stawiana jest na podstawie szczegółowego wywiadu lekarskiego i badania fizykalnego. Pacjenci z kamieniem moczowodu zazwyczaj zgłaszają ból w okolicy lędźwiowej, wymioty, czasami gorączkę, jednak przebieg może być również bezobjawowy [29]. Badanie ultrasonograficzne (USG) powinno być stosowane jako podstawowe narzędzie obrazowania, chociaż łagodzenie bólu lub jakiekolwiek inne nadzwyczajne środki postępowania nie powinny być wdrażane z opóźnieniem z powodu zastosowania metod obrazowania. Badanie ultrasonograficzne jest bezpieczne, powtarzalne i niedrogie. Identyfikuje kamienie znajdujące się w kielichach, miedniczce oraz połączeniach miedniczkowo-moczowodowych i moczowodowo-pęcherzowych (badanie ultrasonograficzne z wypełnionym pęcherzem), jak również kamienie u pacjentów z poszerzeniem górnych dróg moczowych. Badanie ultrasonograficzne ma czułość 45% i swoistość 94% dla kamieni moczowodu oraz czułość 45% i swoistość 88% dla kamieni nerkowych [30, 31]. Czułość i swoistość badania rentgenowskiego wynoszą odpowiednio 44-77% i 80-87% [32]. Badanie rentgenowskie nie powinno być wykonywane, jeśli rozważana jest tomografia komputerowa bez kontrastu [33], chociaż jest pomocne w różnicowaniu pomiędzy kamieniami cieniującymi i niecieniującymi oraz dla porównania w okresie follow-up. 
1.3.1.1. Ocena pacjentów z ostrym bólem w okolicy lędźwiowej/podejrzeniem obecności kamieni moczowodówTomografia komputerowa bez kontrastu stała się standardem w diagnostyce ostrego bólu okolicy lędźwiowej i zastąpiła urografię. Tomografia komputerowa bez kontrastu określa średnicę i gęstość kamienia. Gdy kamienie są nieobecne, przyczyna bólu brzucha powinna zostać zidentyfikowana. W ocenie pacjentów z podejrzeniem ostrej kamicy moczowej TK bez kontrastu wydaje się być znacznie bardziej dokładna niż pielografia [34]. 
Tomografia komputerowa bez kontrastu umożliwia wykrycie kamieni zbudowanych z ksantyny i kwasu moczowego, które nie cieniują na rentgenowskich zdjęciach przeglądowych, jednak umożliwia wykrycie kamieni z indynawiru [35]. W tomografii komputerowej bez kontrastu można określić gęstość kamienia, wewnętrzną strukturę, odległości kamienia od skóry i anatomię okolicy, co wpływa na wybór metody leczenia [28, 36-38]. Korzystając z zalet obrazowania bez kontrastu, należy pamiętać o wadach tej metody: braku informacji o czynności nerek i anatomii układu zbierania moczu, a także o większej dawce promieniowania (tab. 1.3.1).
Ryzyko promieniowania może być zmniejszone przez zastosowanie tomografii komputerowej o niskiej dawce [39]. U pacjentów z indeksem masy ciała (BMI) <30 przy zastosowaniu TK o niskiej dawce wykazano czułość 86% w wykrywaniu kamieni moczowodu <3 mm i 100% dla kamieni >3 mm [40]. Metaanaliza badań prospektywnych [41] wykazała, że przy zastosowaniu TK o niskiej dawce diagnozowano kamicę moczową z czułością 96,6% (95% CI: 95,0-97,8) i swoistością 94,9% (95% CI: 92,0-97,0). 1.3.1.2. Ocena radiologiczna pacjentów z kamicą nerkową
1.3.2. Diagnostyka metaboliczna
1.3.2.1. Podstawowe badania laboratoryjne - pacjenci bez nagłego epizodu kamicy moczowejBadania biochemiczne są jednakowe dla wszystkich pacjentów z kamicą moczową. Jeśli jednak nie jest planowana interwencja operacyjna, to badanie stężenia sodu, potasu, białka C-reaktywnego we krwi i czas krzepnięcia mogą zostać pominięte. Tylko pacjenci z wysokim ryzykiem nawrotu kamieni powinni zostać poddani bardziej szczegółowym badaniom [16]. Najprostszym sposobem postawienia prawidłowej diagnozy jest analiza kamienia przy użyciu zwalidowanych metod wymienionych poniżej (patrz 1.3.2.2). Gdy skład kamienia jest znany, można określić ewentualne zaburzenia metaboliczne. 1.3.2.2. Analiza składu kamieniaAnalizę składu kamienia należy wykonać u wszystkich pacjentów z kamieniem tworzącym się po raz pierwszy. W praktyce klinicznej powtórna analiza kamieni jest potrzebna w przypadku: Pacjenci powinni być poinformowani o konieczności filtrowania moczu w celu pobrania złogów do analizy. Wydalenie kamienia i przywrócenie prawidłowej czynności nerek powinno zostać potwierdzone. Do preferowanych metod należą spektroskopia w podczerwieni (IRS) lub dyfrakcja promieniowania rentgenowskiego (XRD) [49-51]. Równoważne wyniki można uzyskać poprzez mikroskopię polaryzacyjną, ale tylko w ośrodkach klinicznych mających doświadczenie w zastosowaniu tego rodzaju metody. Analiza chemiczna jest powszechnie uważana za przestarzałą [49]. 
1.3.3. Diagnostyka u szczególnych grup pacjentów1.3.3.1. Diagnostyka obrazowa w czasie ciążyU kobiet w ciąży diagnostyka obrazowa (ekspozycja na promieniowanie jonizujące) może wiązać się z teratogennością płodu i ryzykiem rozwoju nowotworów okresu dzieciństwa. Ryzyko dla dziecka zależy w dużej mierze od wieku ciążowego i ilości dostarczonego promieniowania. Obrazowanie rentgenowskie podczas pierwszego trymestru ciąży powinno być zarezerwowane dla pacjentek, u których nie udało się zastosować innych metod obrazowania [52, 53]. USG stało się podstawowym narzędziem diagnostyki radiologicznej przy ocenie pacjentek w ciąży z podejrzeniem kamicy moczowej. Jednak fizjologiczne zmiany w okresie ciąży mogą imitować niedrożność moczowodu [54]. Obrazowanie metodą rezonansu magnetycznego (MRI) może być stosowane jako procedura drugiego rzutu, w celu określenia poziomu niedrożności dróg moczowych oraz wykonania wizualizacji kamieni [55, 56]. Protokoły wykonania TK o niskiej dawce zmniejszają narażenie na promieniowanie i są obecnie zalecane w celu stosowania u kobiet w ciąży, jako opcja ostatniego rzutu [57, 58]. 
1.3.3.2. DzieciDzieci i młodzież z kamicą moczową mają wysokie ryzyko nawrotu kamicy; dlatego standardowe procedury diagnostyczne dla pacjentów z grup wysokiego ryzyka mają w tym przypadku zastosowanie. 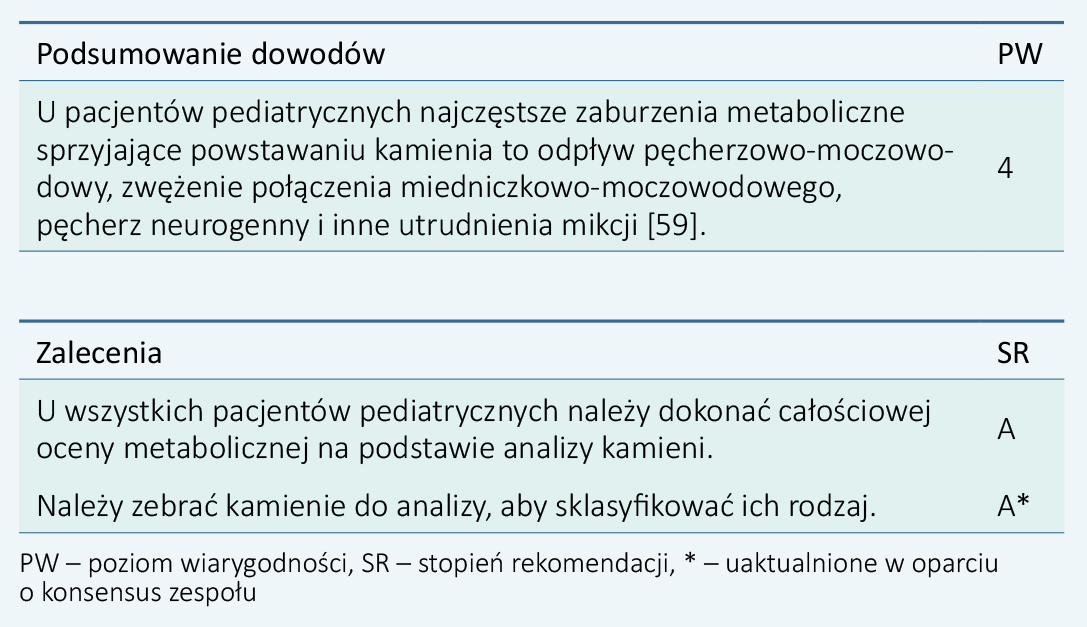
1.3.3.2.1. Diagnostyka obrazowaPrzy wyborze procedur diagnostycznych w celu identyfikacji kamicy moczowej u dzieci należy pamiętać, że pacjenci mogą być niechętni do współpracy, wymagają znieczulenia oraz są wrażliwi na promieniowanie jonizujące [60-62]. Należy zastosować zasadę najniższej możliwej dawki promieniowania. 1.3.3.2.2. UltrasonografiaUSG jest podstawową techniką obrazowania [60] w pediatrii. Jej zaletą jest brak konieczności znieczulenia pacjenta oraz brak promieniowania. Obrazowanie powinno dotyczyć zarówno wypełnionego pęcherza wraz z przylegającą częścią moczowodów, jak i górnych części moczowodów [63-67]. Badanie USG Color Doppler wykazuje różnice w budowie moczowodów [64], a także opór tętnic łukowatych obu nerek, co jest wskaźnikiem stopnia niedrożności [65]. Niemniej jednak w badaniu USG nie udało się zidentyfikować kamieni u więcej niż 40% pacjentów pediatrycznych [66-69] (PW: 4), USG umożliwia zdobycie jedynie ograniczonych informacji na temat czynności nerek. 1.3.3.2.3. RadiografiaRadiografia nerek, moczowodów i pęcherza może pomóc w identyfikacji kamieni i ich właściwości względem promieniowania, co ułatwia dalsze postępowanie z pacjentem. 1.3.3.2.4. UrografiaDawka promieniowania dla urografii jest porównywalna do dawki w cystografii mikcyjnej (0,33 mSV) [70]. Jednakże konieczność wstrzyknięcia środka kontrastującego to istotna wada metody. 1.3.3.2.5. Spiralna tomografia komputerowaNajnowsze protokoły zastosowania niskiej dawki TK wykazały znaczącą redukcję ekspozycji na promieniowanie [45, 71]. U dzieci tylko 5% kamieni nie udaje się wykryć w TK bez kontrastu [57, 64, 71]. Sedacja lub znieczulenie są rzadko potrzebne ze względu na nowoczesną aparaturę urządzenia. 1.3.3.2.6. Urografia rezonansu magnetycznegoUrografia rezonansu magnetycznego nie może być stosowana do wykrywania kamieni moczowych. Może jednak dostarczyć szczegółowe informacje o anatomii układu moczowego, lokalizacji przeszkody lub zwężenia w moczowodzie, a także o morfologii miąższu nerkowego [72]. 
Oprac.: lek. staż. Michał Matuszewski
Samodzielny Publiczny Szpital Kliniczny im. prof. W. Orłowskiego, Warszawa
Tekst jest tłumaczeniem rozdziału The EAU Urolithiasis Guidelines, 2015 Piśmiennictwo:
1.Skolarikos, A., et al. Metabolic evaluation and recurrence prevention for urinary stone patients:
EAU guidelines. Eur Urol, 2015. 67: 750.
2.Turk, C., et al. EAU Guidelines on Interventional Treatment for Urolithiasis. Eur Urol, 2015.
3.Turk, C., et al. EAU Guidelines on Diagnosis and Conservative Management of Urolithiasis.
Eur Urol, 2015.
4.Tiselius, H.G., et al. Guidelines on urolithiasis. Eur Urol, 2001. 40: 362.
5.Preminger, G.M., et al. 2007 Guideline for the management of ureteral calculi. Eur Urol, 2007. 52: 1610.
6.Preminger, G.M., et al. 2007 guideline for the management of ureteral calculi. J Urol, 2007. 178: 2418.
7.MacLennan S., et al. What are the comparative benefits and harms of the different percutaneous nephrolithotomy (PCNL) tract sizes? PROSPERO International prospective register of systematic reviews, 2015.
8.Phillips, B., et al. Oxford Centre for Evidence-based Medicine Levels of Evidence. Updated by Jeremy Howick March 2009.
9.Trinchieri., et al., Epidemiology, in Stone Disease, K.S. C.P. Segura JW, Pak CY, Preminger GM, Tolley D., Eds. Health Publications: Paris. 2003.
10.Stamatelou, K.K., et al. Time trends in reported prevalence of kidney stones in the United States: 1976-1994. Kidney Int, 2003. 63: 1817.
11.Hesse, A., et al. Study on the prevalence and incidence of urolithiasis in Germany comparing the years 1979 vs. 2000. Eur Urol, 2003. 44: 709.
12.Sanchez-Martin, F.M., et al. [Incidence and prevalence of published studies about urolithiasis in Spain. A review]. Actas Urol Esp, 2007. 31: 511.
13.Yasui, T., et al. Association of the loci 5q35.3, 7q14.3, and 13.q14.1 with urolithiasis: A case-control study in the Japanese population, involving genome-wide association study. J Urol, 2013. 189: e854.
14.Strohmaier, W.L. Course of calcium stone disease without treatment. What can we expect?
Eur Urol, 2000. 37: 339.
15.Keoghane, S., et al. The natural history of untreated renal tract calculi. BJU Int, 2010. 105: 1627.
16.Straub, M., et al. Diagnosis and metaphylaxis of stone disease. Consensus concept of the National Working Committee on Stone Disease for the upcoming German Urolithiasis Guideline.
World J Urol, 2005. 23: 309.
17.Hesse, A.T., et al. (Eds.), Urinary Stones, Diagnosis, Treatment and Prevention of Recurrence. 3rd edition. 2009, Basel.
18.Basiri, A., et al. Familial relations and recurrence pattern in nephrolithiasis: new words about old subjects. Urol J, 2010. 7: 81.
19.Goldfarb, D.S., et al. A twin study of genetic and dietary influences on nephrolithiasis: a report from the Vietnam Era Twin (VET) Registry. Kidney Int, 2005. 67: 1053.
20.Asplin, J.R., et al. Hyperoxaluria in kidney stone formers treated with modern bariatric surgery.
J Urol, 2007. 177: 565.
21.Gonzalez, R.D., et al. Kidney stone risk following modern bariatric surgery. Curr Urol Rep, 2014. 15: 401.
22.Rendina, D., et al. Metabolic syndrome and nephrolithiasis: a systematic review and meta-analysis of the scientific evidence. J Nephrol, 2014. 27: 371.
23.Dell?Orto, V.G., et al. Metabolic disturbances and renal stone promotion on treatment with topiramate: a systematic review. Br J Clin Pharmacol, 2014. 77: 958.
24.Mufti, U.B., et al. Nephrolithiasis in autosomal dominant polycystic kidney disease.
J Endourol, 2010. 24: 1557.
25.Chen, Y., et al. Current trend and risk factors for kidney stones in persons with spinal cord injury: a longitudinal study. Spinal Cord, 2000. 38: 346.
26.Leusmann, D.B., et al. Results of 5,035 stone analyses: a contribution to epidemiology of urinary stone disease. Scand J Urol Nephrol, 1990. 24: 205.
27.Leusmann, D.B. Whewellite, weddellite and company: where do all the strange names originate? BJU Int, 2000. 86: 411.
28.Kim, S.C., et al. Cystine calculi: correlation of CT-visible structure, CT number, and stone morphology with fragmentation by shock wave lithotripsy. Urol Res, 2007. 35: 319.
29.Wimpissinger, F., et al. The silence of the stones: asymptomatic ureteral calculi. J Urol, 2007. 178: 1341.
30.Ray, A.A., et al. Limitations to ultrasound in the detection and measurement of urinary tract calculi. Urology, 2010. 76: 295.
31.Smith-Bindman, R., et al. Ultrasonography versus computed tomography for suspected nephrolithiasis. N Engl J Med, 2014. 371: 1100.
32.Heidenreich, A., et al. Modern approach of diagnosis and management of acute flank pain: review of all imaging modalities. Eur Urol, 2002. 41: 351.
33.Kennish, S.J., et al. Is the KUB radiograph redundant for investigating acute ureteric colic in the non-contrast enhanced computed tomography era? Clin Radiol, 2008. 63: 1131.
34.Worster, A., et al. The accuracy of noncontrast helical computed tomography versus intravenous pyelography in the diagnosis of suspected acute urolithiasis: a meta-analysis. Ann Emerg Med, 2002. 40: 280.
35.Wu, D.S., et al. Indinavir urolithiasis. Curr Opin Urol, 2000. 10: 557.
36.El-Nahas, A.R., et al. A prospective multivariate analysis of factors predicting stone disintegration by extracorporeal shock wave lithotripsy: the value of high-resolution noncontrast computed tomography. Eur Urol, 2007. 51: 1688.
37.Patel, T., et al. Skin to stone distance is an independent predictor of stone-free status following shockwave lithotripsy. J Endourol, 2009. 23: 1383.
38.Zarse, C.A., et al. CT visible internal stone structure, but not Hounsfield unit value, of calcium oxalate monohydrate (COM) calculi predicts lithotripsy fragility in vitro. Urol Res, 2007. 35: 201.
39.Jellison, F.C., et al. Effect of low dose radiation computerized tomography protocols on distal ureteral calculus detection. J Urol, 2009. 182: 2762.
40.Poletti, P.A., et al. Low-dose versus standard-dose CT protocol in patients with clinically suspected renal colic. AJR Am J Roentgenol, 2007. 188: 927.
41.Niemann, T., et al. Diagnostic performance of low-dose CT for the detection of urolithiasis: a meta-analysis. AJR Am J Roentgenol, 2008. 191: 396.
42.Kluner, C., et al. Does ultra-low-dose CT with a radiation dose equivalent to that of KUB suffice to detect renal and ureteral calculi? J Comput Assist Tomogr, 2006. 30: 44.
43.Caoili, E.M., et al. Urinary tract abnormalities: initial experience with multi-detector row CT urography. Radiology, 2002. 222: 353.
44.Van Der Molen, A.J., et al. CT urography: definition, indications and techniques. A guideline for clinical practice. Eur Radiol, 2008. 18: 4.
45.Thomson, J.M., et al. Computed tomography versus intravenous urography in diagnosis of acute flank pain from urolithiasis: a randomized study comparing imaging costs and radiation dose. Australas Radiol, 2001. 45: 291.
46.(2010) S-3 Guideline AWMF-Register-Nr. 043/044 Urinary Tract Infections. Epidemiology, diagnostics, therapy and management of uncomplicated bacterial community acquired urinary tract infections in adults.
47.Pearle M.S., A.J.R., Coe F.L., et al. , Medical management of urolithiasis. 2nd International consultation on Stone Disease, ed. K.S. Denstedt J. 2008.
48.Mandel, N., et al. Conversion of calcium oxalate to calcium phosphate with recurrent stone episodes. J Urol, 2003. 169: 2026.
49.Hesse, A., et al. Quality control in urinary stone analysis: results of 44 ring trials (1980-2001).
Clin Chem Lab Med, 2005. 43: 298.
50.Sutor, D.J., et al. Identification standards for human urinary calculus components, using crystallographic methods. Br J Urol, 1968. 40: 22.
51.Abdel-Halim, R.E., et al. A review of urinary stone analysis techniques. Saudi Med J, 2006. 27: 1462.
52.Swartz, M.A., et al. Admission for nephrolithiasis in pregnancy and risk of adverse birth outcomes. Obstet Gynecol, 2007. 109: 1099.
53.Patel, S.J., et al. Imaging the pregnant patient for nonobstetric conditions: algorithms and radiation dose considerations. Radiographics, 2007. 27: 1705.
54.Asrat, T., et al. Ultrasonographic detection of ureteral jets in normal pregnancy. Am J Obstet Gynecol, 1998. 178: 1194.
55.Roy, C., et al. Assessment of painful ureterohydronephrosis during pregnancy by MR urography.
Eur Radiol, 1996. 6: 334.
56.Juan, Y.S., et al. Management of symptomatic urolithiasis during pregnancy. Kaohsiung J Med Sci, 2007. 23: 241.
57.Cody, D.D., et al. Strategies for formulating appropriate MDCT techniques when imaging the chest, abdomen, and pelvis in pediatric patients. AJR Am J Roentgenol, 2004. 182: 849.
58.Masselli, G., et al. Stone disease in pregnancy: imaging-guided therapy. Insights Imaging, 2014. 5: 691.
59.Sternberg, K., et al. Pediatric stone disease: an evolving experience. J Urol, 2005. 174: 1711.
60.Palmer, L.S. Pediatric urologic imaging. Urol Clin North Am, 2006. 33: 409.
61.Passerotti, C., et al. Ultrasound versus computerized tomography for evaluating urolithiasis.
J Urol, 2009. 182: 1829.
62.Tasian, G.E., et al. Evaluation and medical management of kidney stones in children. J Urol, 2014. 192: 1329.
63.Riccabona, M., et al. Imaging recommendations in paediatric uroradiology. Minutes of the ESPR uroradiology task force session on childhood obstructive uropathy, high-grade fetal hydronephrosis, childhood haematuria, and urolithiasis in childhood. ESPR Annual Congress, Edinburgh, UK, June 2008. Pediatr Radiol, 2009. 39: 891.
64.Darge, K., et al. [Modern ultrasound technologies and their application in pediatric urinary tract imaging]. Radiologe, 2005. 45: 1101.
65.Pepe, P., et al. Functional evaluation of the urinary tract by color-Doppler ultrasonography (CDU) in 100 patients with renal colic. Eur J Radiol, 2005. 53: 131.
66.Oner, S., et al. Comparison of spiral CT and US in the evaluation of pediatric urolithiasis. Jbr-btr, 2004. 87: 219.
67.Palmer, J.S., et al. Diagnosis of pediatric urolithiasis: role of ultrasound and computerized tomography. J Urol, 2005. 174: 1413.
68.Riccabona, M., et al. Conventional imaging in paediatric uroradiology. Eur J Radiol, 2002. 43: 100.
69.Chateil, J.F., et al. [Practical measurement of radiation dose in pediatric radiology: use of the dose surface product in digital fluoroscopy and for neonatal chest radiographs]. J Radiol, 2004. 85: 619.
70.Stratton, K.L., et al. Implications of ionizing radiation in the pediatric urology patient. J Urol, 2010. 183: 2137.
71.Tamm, E.P., et al. Evaluation of the patient with flank pain and possible ureteral calculus. Radiology, 2003. 228: 319.
komentarze
Hello there,
My name is Aly and I would like to know if you would have any interest to have your website here at przeglad-urologiczny.pl promoted as a resource on our blog alychidesign.com ?
We are in the midst of updating our broken link resources to include current and up to date resources for our readers. Our resource links are manually approved allowing us to mark a link as a do-follow link as well
.
If you may be interested please in being included as a resource on our blog, please let me know.
Thanks,
Aly
|
||||||||||||||||||||||||||||||
