| ||||||||
Zwężenia cewki moczowej - współczesny problem terapeutycznyZ problemem zwężeń cewki moczowej w codziennej praktyce lekarskiej styka się każdy urolog, jednak ze względu na różnorodność etiologii, stopnia zaawansowania, jak również brak jednolitego systemu rejestracji trudno oszacować częstość występowania tego schorzenia. Wzrasta ona z wiekiem, a dostępne statystyki szacują, że występuje u 0,6-1,4% populacji [1, 2]. Dane brytyjskie sugerują występowanie objawowych zwężeń cewki u 1:2000 pacjentów, rosnące z wiekiem do 1:200 [3]. Przegląd etiologii zwężeń przedstawiono w tabeli 1 [3]. Wśród najczęstszych przyczyn zwężeń cewki moczowej obecnie obserwuje się przyczyny jatrogenne i idiopatyczne, przy czym grupa pierwsza dominuje u mężczyzn po 45. roku życia, a grupa druga przed 45. rokiem życia [4, 5]. Zwężenia będące wynikiem działalności terapeutycznej występują na całym przebiegu cewki moczowej - od ujścia zewnętrznego do szyi pęcherza, jednoznacznie należy jednak odróżnić zwężenia cewki przedniej od części tylnej. Zwężenia w obrębie ujścia, cewki prąciowej i opuszkowej związane są z odczynem bliznowacenia i włóknienia ciała gąbczastego, co stanowi istotę przebiegu chorobowego. Proces ten wynika z urazu zewnętrznego lub przerwania ciągłości delikatnego nabłonka cewki indukującego proces zapalny ciała gąbczastego. Ten ostatni może być potęgowany poprzez kontakt ciała gąbczastego z moczem podczas aktu mikcji [6]. Zwężenia cewki tylnej stanowią heterogenną grupę schorzeń związaną najczęściej z leczeniem operacyjnym, w tym również z rozwojem nowych technologii. Podział ten implikuje dalsze postępowanie i spodziewane wyniki leczenia zupełnie różne dla części przedniej i tylnej cewki moczowej. Podczas diagnostyki zwężeń należy również pamiętać, iż objawy i pomiar przepływu cewkowego mogą być mylące. Przy prawidłowej funkcji pęcherza moczowego przepływ cewkowy nie ulega pogorszeniu do momentu, kiedy średnica cewki osiąga szerokość poniżej 10 F [7]. Obecnym standardem diagnostyki są uretrografia wstępująca i cystouretrografia mikcyjna, a w razie potrzeby wykonanie uretrocystoskopii [7].
Zwężenia części przedniejZwężenie ujścia zewnętrznego cewki często są bezobjawowe. Zwykle występują bez towarzyszącego zwężenia w części proksymalnej i często bez uchwytnej przyczyny. Mogą być wynikiem instrumentacji cewki podczas cystoskopii czy cewnikowania. Czynnikiem ryzyka jest również obrzezanie. Przyczyną tego powikłania może być uszkodzenie tętnicy wędzidełkowej z następowym niedokrwieniem ujścia zewnętrznego lub niespecyficzny proces zapalny wtórny do działających sił tarcia [8]. Po obrzezaniu w wieku dziecięcym główną przyczyną zwężenia ujścia zewnętrznego cewki jest „pieluszkowe” zapalenie tej okolicy. Zwężenie może pojawić się wiele lat po obrzezaniu, co utrudnia ustalenie związku i wiarygodne oszacowane skali tego zjawiska [9]. Kolejną interwencją urologiczną, której powikłaniem może być zwężenie cewki moczowej, jest przezcewkowa elektroresekcja stercza. Częstość tego powikłania wynosi 1,9-20% [6, 10, 11]. Patofizjologia zwężeń po przezcewkowej elektroresekcji stercza - TUR-P jest wielopłaszczyznowa. Traumatyzacja może być związana z samym zabiegiem, co potwierdza mniejszy odsetek zwężeń po zabiegach z użyciem resektoskopu o mniejszej średnicy [12]. Podłożem zwężenia może być uraz termiczny niedostatecznie izolowanej pętli elektrycznej [13]. Aplikacja żelu do cewki przed resekcją, a podczas przedłużającego się zabiegu wprowadzenie dodatkowej porcji żelu do cewki zapobiega nadmiernemu gromadzeniu się ładunków, a tym samym urazowi termicznemu [14]. Zużyte przewody i pętle resektoskopów wytwarzają opory zwiększające uraz termiczny i ryzyko zwężeń [15]. Publikowane prace dotyczące ryzyka zwężeń po wykonaniu elektroresekcji bipolarnej versus monopolarnej prezentują sprzeczne wyniki [11, 16]. Kolejnym czynnikiem ryzyka zwężeń cewki po TUR-P jest długotrwałe utrzymywanie cewnika przed zabiegiem oraz powyżej 3 dni po zabiegu, a tym samym nekroza delikatnego nabłonka wywołana uciskiem na zmienioną zapalnie w wyniku infekcji podtrzymywanej przez cewnik cewki [10]. Udoskonalenie techniczne i wprowadzenie cewników silikonowych zmniejsza odsetek tych powikłań. Doniesienia dotyczące związku z zakażeniem i florą bakteryjną cewki prezentują sprzeczne wyniki. Zwężenia cewki stanowią istotny problem związany z zabiegami kardiochirurgicznymi. Podczas zabiegów wykorzystujących krążenie pozaustrojowe dochodzi do niedokrwienia cewki, co potwierdza zmniejszenie przepływu naczyniowego w opcji Dopplera w cewce moczowej [17]. Użycie cewników silikonowych, jak również minimalizacja średnicy cewnika obniża odsetek powikłań pod postacią zwężenia cewki [18]. Podobnie zastosowanie cystostomii nadłonowej podczas zabiegów kardiochirurgicznych zmniejsza odsetek zwężeń z 6,6% do 0% w porównaniu z cewnikowaniem [19]. Przewlekłe cewnikowanie przerywane również niesie ryzyko traumatyzacji i zwężenia cewki [20]. Nowe technologie, takie jak zastosowanie cewników hydrofilnych, umożliwiają cewnikowanie przerywane bez użycia żelu. Leczenie zachowawcze zwężeń cewki przedniej Rozszerzenie i rozcięcie endoskopowe cewki jest metodą zalecaną jedynie w pojedynczych, krótkich, nieurazowych zwężeniach bez lub z nieznacznym odczynem zwłóknienia ciała gąbczastego. Odsetek satysfakcjonujących wyników sięga wtedy 39-73% [21, 22]. Każda kolejna interwencja zmniejsza odsetek powodzeń [21, 22]. Pomimo iż uretrotomia prawie nigdy nie jest popostępowaniem skutecznym w przypadku zwężeń z odczynem zwłóknienia lub nawrotowych, wielu urologów, postępując zgodnie z „drabiną rekonstrukcyjną”, powtarza wielokrotnie zabieg rozszerzenia i uretrotomii, pozostawiając uretroplastykę jako zabieg ostatniej szansy [23]. Takie postępowanie pogarsza warunki i ostateczne efekty uretroplastyki. Wraz z rozwojem medycyny, dostępności antybiotyków, sprzętu i rozwoju nowych technik oraz wzrostem świadomości i szybszą kwalifikacją do zabiegu uretroplastyka staje się zabiegiem coraz bardziej skutecznym i bezpiecznym [3]. Kalkulacje ekonomiczne leczenia zwężeń cewki sugerują, iż wykonywanie więcej niż jednej uretrotomii przed zabiegiem uretroplastyki generuje wyższe koszty, mnożąc liczbę zabiegów potrzebnych do osiągnięcia długotrwałego efektu terapeutycznego [24]. Autorzy sugerują, iż w wielu przypadkach, jak wspomniano w wytycznych poniżej, uretroplastyka wykonana jako leczenie pierwszego rzutu zapewnia najlepsze wyniki [24]. Najnowsze wytyczne międzynarodowego panelu ekspertów [25]
Uretroplastyka zwężeń cewki przedniej Operacje części prąciowej cewki stanowią większe niż cewka opuszkowa wyzwanie chirurgiczne, mając na celu zapewnienie dobrego efektu estetycznego i funkcjonalnego. Rozmiar graftu czy płata uszypułowanego musi zapewnić odpowiednie światło cewki, sposób przyszycia materiału musi gwarantować dobre podparcie, jednak bez napięcia grożącego niedokrwieniem. Uwzględnić należy możliwość obkurczenia się materiału, następowego skrzywienia prącia oraz konieczności usunięcia graftu i rozpoczynania procedury od początku. Zespolenie koniec do końca stosowane w znacznym zwłóknieniu ciała gąbczastego może prowadzić do deformacji i skrzywienia prącia. Z tego względu przy długim brakującym odcinku cewki potrzebna jest suplementacja graftem. Szczególną dbałość należy wykazać w zapobieganiu infekcjom i krwiakom pooperacyjnym, które mogą jak wyżej zniweczyć wynik zabiegu. Olbrzymie znaczenie ma doświadczenie operatora i dobór techniki „szytej na miarę” w zależności od warunków miejscowych tkanek i całości obrazu klinicznego. Przegląd najczęściej stosowanych technik uretroplastyki cewki przedniej przedstawia tabela 2. Postępowanie w przypadku zwężeń dystalnego odcinka cewki jest bardzo różne, w zależności od etiologii: od prostej meatotomii, po rekonstrukcje jedno- lub dwuetapowe z użyciem błony śluzowej, tj. w przypadku Lichen sclerosus, czy złożone zabiegi rekonstrukcyjne w przypadku spodziectwa uwzględniające nie tylko zwężenie cewki, ale również skrzywienie prącia, deformacje żołędzi, obecność struny ścięgnistej i pracę przy niedoborze wartościowych tkanek. W przypadku Lichen sclerosus zwężenie rozpoczynające się dystalnie rozprzestrzenia się proksymalnie z zajęciem dołka łódkowatego, cewki prąciowej z dużym odczynem włóknienia; w ciężkiej formie może przebiegać z zajęciem skóry prącia. Z zasady należy wyciąć zbliznowaciałe tkanki i suplementować lub zastąpić materiałem niepodatnym na chorobę, tj. błoną śluzową policzka.
Decyzja o postępowaniu jedno- lub dwuetapowym zależy od warunków miejscowych. Technikę suplementacji dwuetapowej cewki z użyciem błony śluzowej w odcinku żołędziowym i wiszącym przedstawiają fotografie serii 1. W zwężeniach cewki prąciowej jedną z dostępnych technik jest sposób Orandi, polegający na mobilizacji uszypułowanego na błonie kurczliwej płata skóry po brzusznej stronie prącia, następnie odwróceniu go o 180 stopni i wszyciu krawędzi w rozcięcie brzuszne cewki prąciowej [26]. Warunkiem niezbędnym jest wystarczająca do estetycznego zamknięcia ilość skóry. Metoda nie może mieć zastosowania w Lichen sclerosus. Alternatywą jest technika Asopa, polegająca na strikturotomii grzbietowej z implantacją graftu poprzez dostęp przez rozcięcie brzuszne cewki [27]. Kolejną możliwość stanowi rozcięcie grzbietowe cewki z mobilizacją jednostronną lub całkowitą i implantacja graftu po stronie grzbietowej, możliwa również w Lichen sclerosus. Technikę przedstawiają fotografie serii 2. Dwie ostatnie techniki nie mają zastosowania przy znacznym zwłóknieniu ciała gąbczastego czy znacznym ograniczeniu światła cewki moczowej. Taka sytuacja może mieć miejsce po urazach cewki, np. z towarzyszącym złamaniem prącia. Zaopatrzenie tego typu zwężeń wymaga doświadczenia. Opcją dla tych pacjentów jest wycięcie zwłókniałego fragmentu cewki i zespolenie koniec do końca, czasem z koniecznością suplementacji błoną śluzową od strony grzbietowej, podobnie jak w przypadku cewki opuszkowej. Technikę przedstawiają fotografie serii 3. W centrach referencyjnych przy jednoczasowym zaopatrywaniu złamania prącia z urazem cewki moczowej ubytek osłonki białawej ciał jamistych zaopatruje się materiałem sztucznym, który pokryty zostaje warstwą błony kurczliwej. Na tak przygotowane podłoże naszywa się błonę śluzową policzka, pozostawiając na otwarto do wygojenia i następowej tubularyzacji po około 3 miesiącach. U wybranej grupy pacjentów ze skomplikowanym zwężeniem, brakiem zgody lub przeciwwskazaniami do leczenia rekonstrukcyjnego optymalnym rozwiązaniem może być wyprowadzenie cewki na krocze. 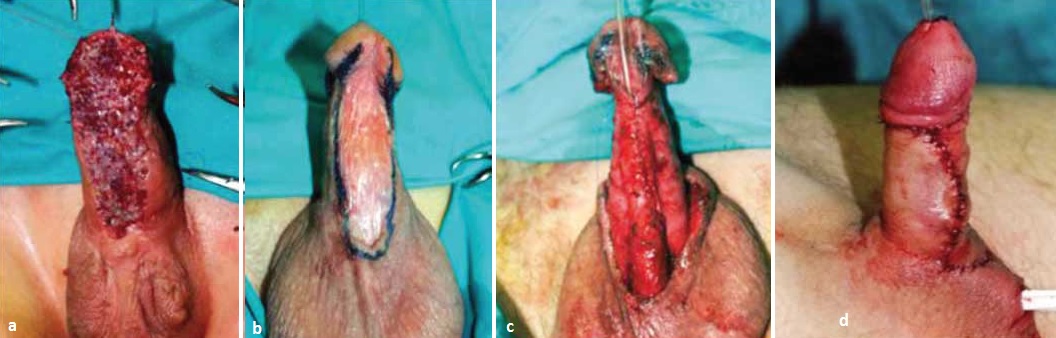 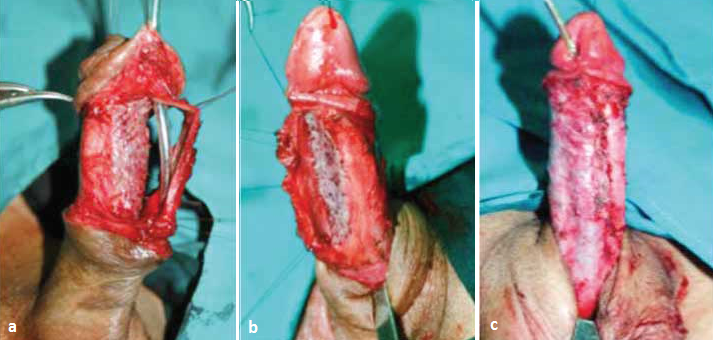 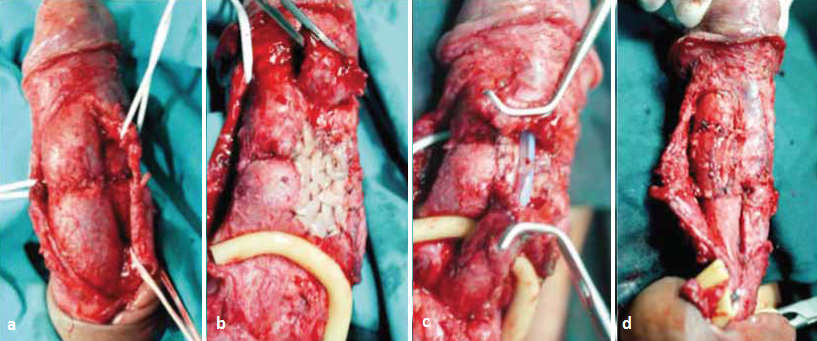 Leczenie operacyjne zwężeń cewki opuszkowej Wybór techniki zależy od wielu czynników, takich jak
obraz kliniczny, lokalne warunki zabiegu, jakość tkanek
oraz preferencje urologa znającego dostępne techniki.
Priorytetem zabiegu jest odtworzenie drożności
przy zachowaniu trwałości struktury cewki, zachowanie
funkcji opuszki i mięśnia opuszkowo-gąbczastego
- opróżniania cewki opuszkowej po mikcji oraz zachowanie
funkcji seksualnych. Klasyczną techniką leczenia
krótkich (<2 cm) zwężeń z dużym odczynem włóknienia
jest wycięcie zwężenia, nacięcie obu końców
i zespolenie beznapięciowe koniec do końca [28]. Odsetek
skuteczności takiego leczenia przekracza 90%,
przy mniejszej niż inne metody liczbie powikłań
i zwężeń nawrotowych [28]. Wycięcie dłuższego fragmentu
lub zespolenie pod napięciem niesie ryzyko niedokrwienia
i nawrotu zwężenia oraz skrócenia i skrzywienia
prącia, jednak niektórzy autorzy raportują
dobre wyniki leczenia przy zwężeniach opuszki proksymalnej
do 5 cm [29]. Przecięcie ciała gąbczastego
w rejonie opuszki niesie ze sobą ryzyko uszkodzenia tętnic
cewkowych i pogorszenia wstecznego dopływu krwi
do cewki, co jest szczególnie istotne przy upośledzeniu
dystalnego ukrwienia cewki, np. poprzednie leczenie
zabiegowe cewki/prącia, spodziectwo, pacjenci starsi
z chorobami naczyniowymi czy potencjalni kandydaci
do implantacji sztucznego zwieracza. Również ze
względu na sąsiedztwo struktur nerwowych odpowiedzialnych
za erekcję uszkodzenie tej okolicy może skutkować jej pogorszeniem. Wielu autorów nie potwierdza
istotnego upośledzenia funkcji erekcyjnej
po zespoleniu koniec do końca, z przecięciem ciała
gąbczastego, wykazując jednak tendencję do gorszej
funkcji u osób starszych z zaburzeniami występującymi
przed zabiegiem [30]. Zaburzenia erekcji często są
przejściowe i ustępują kilka miesięcy po zabiegu [28].
Jeśli zwężenie nie wymaga wycięcia blizny/zwłóknienia,
zespolenie koniec do końca można wykonać nie
przecinając ciała gąbczastego. W bardzo krótkim zwężeniu
można naciąć śluzówkę w miejscu zwężenia
i wykonać zespolenie tylko tej warstwy w myśl zasady
Heineke-Mikulicza. Przy nieco dłuższym zwężeniu
oprócz nacięcia błony śluzowej wycina się część zwłókniałego
ciała gąbczastego, nie przecinając jednak całej
jego grubości, i zespala śluzówkę jak powyżej lub wykorzystuje
się suplementację graftem [31]. Optymalnym
materiałem ze względu na łatwość pobrania, łatwość
implantacji i wytrzymałość jest błona śluzowa
policzka [7]. Można ją wykorzystać jako graft grzbietowy
- według techniki Barbagli lub po stronie brzusznej
[32]. Dostęp od strony grzbietowej gwarantuje dobre podparcie dla graftu, przecięcie ciała gąbczastego
z minimalnym urazem naczyniowym, wymaga jednak
większej mobilizacji cewki i niesie potencjalnie większe
ryzyko zaburzeń funkcji seksualnych. Ponadto
niektórzy autorzy przy implantacji błony śluzowej po
stronie grzbietowej nie obserwują powikłań w postaci
wypuklenia, tworzenia uchyłka i rzadziej raportują
nawroty zwężeń. Wiele doniesień prezentuje jednak
satysfakcjonujące rezultaty implantacji błoną śluzową
po stronie brzusznej. Implantację błony śluzowej policzka
po stronie grzbietowej w suplementacji zwężenia
cewki opuszkowej przedstawiają fotografie serii 4.
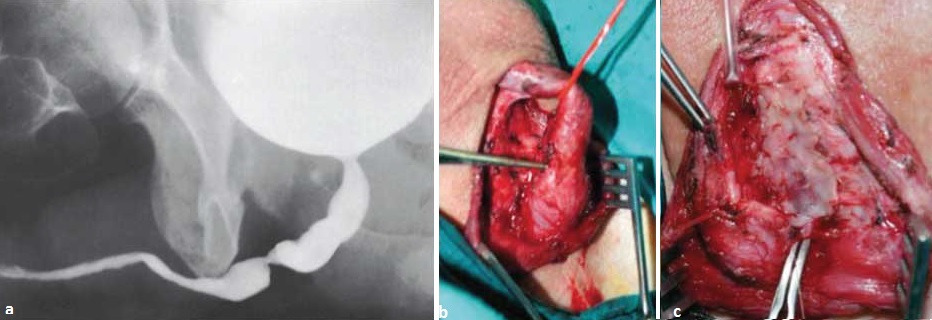 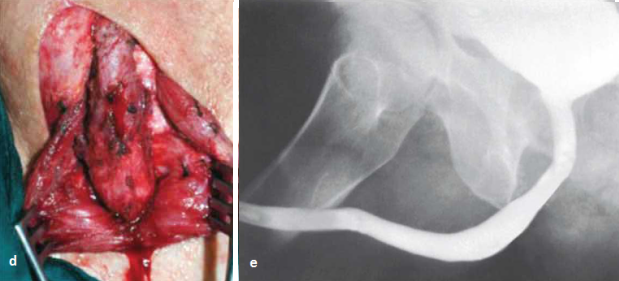 W zależności od warunków miejscowych możliwe są modyfikacje. Przy zwężeniu ze zwłóknieniem, najczęściej pourazowym, po jego wycięciu zespolenie koniec do końca można suplementować błoną śluzową policzka po stronie grzbietowej [33]. Procedurę przedstawiono na fotografiach serii 5. 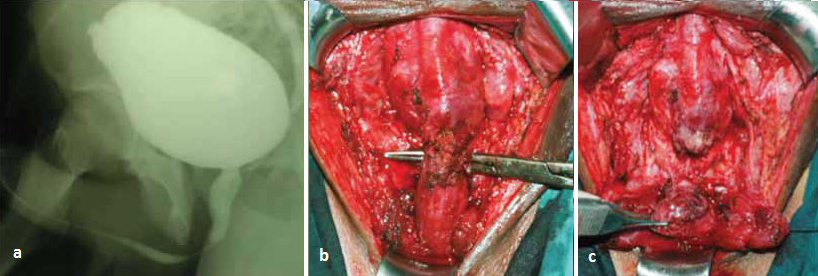 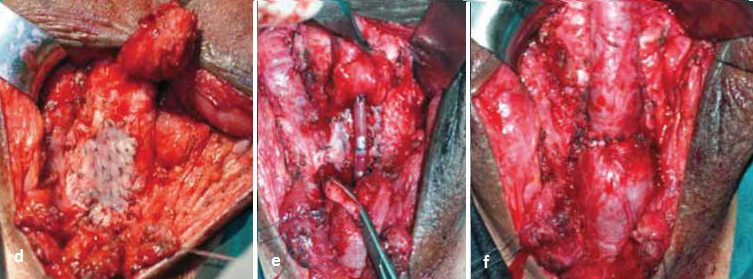 Przy dłuższym zwężeniu ze znacznym zwłóknieniem graft można również implantować po stronie brzusznej i grzbietowej jednoczasowo. Technikę tę ilustrują fotografie serii 6. Jeśli niezbędna jest suplementacja, a loża nie gwarantuje dobrych warunków do przyjęcia graftu, podłoże jest niedokrwione - wtórna interwencja, bliznowacenie, stan po radioterapii, należy rozważyć użycie płata uszypułowanego. 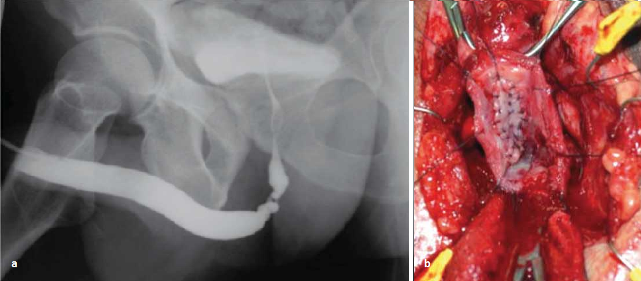 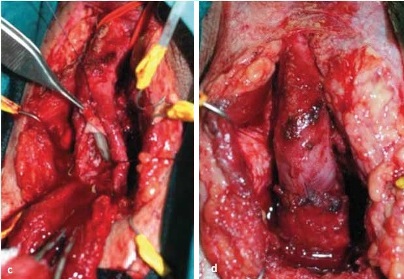 Zwężenia cewki tylnejJatrogenne zwężenia cewki tylnej związane są zwykle z leczeniem schorzeń gruczołu krokowego. Nowe technologie i rozwój procedur minimalnie inwazyjnych, takich jak przezcewkowa termoablacja stercza (trans-urethral microwave thermo-therapy - TUMT), terapia falami ultradźwiękowymi o dużym natężeniu (high intensity focused ultrasound - HIFU), krioablacja, brachyterapia, jak również TUR-P, działających jak czynnik wywołujący mechaniczny lub termiczny uraz niedokrwienny cewki, mogą być przyczyną zwężeń [34, 35]. Zwężenia te lokalizują się w obrębie szyi pęcherza, cewki sterczowej, błoniastej, jak również opuszkowo-błoniastej [35-37]. Odsetek tych zwężeń wraz z doskonaleniem metod diagnostycznych i wzrostem wykrywalności raka stercza poddawanego aktywnemu leczeniu oraz narastającym entuzjazmem wykorzystania nowych technik wzrasta. Zwężenia cewki tylnej po TUR-P Zwężenia cewki tylnej są obecnie rzadkim powikłaniem TUR-P, występują po około 3% zabiegów. Odsetek tego powikłania zmniejszył się w ostatnich latach i najczęściej dotyczy szyi pęcherza, loży stercza lub cewki błoniastej [36, 38]. Zwężenie pojawia się najczęściej kilka do kilkunastu miesięcy po zabiegu, jako nawrót dolegliwości dyzurycznych po początkowej poprawie. Największym czynnikiem ryzyka zwężenia jest mała objętość gruczołu krokowego (<15 ml), a domniemanym mechanizmem rozległa resekcja, elektrokoagulacja szyi pęcherza, odwarstwienie dolnej ściany pęcherza moczowego, duża pętla resekcyjna generująca nadmierne ciepło [39]. Niektórzy autorzy sugerują nacięcie szyi pęcherza zamiast TUR-P przy małej objętości stercza (<15 ml), nawet przy braku endoskopowego obrazu „wysokiej szyi” pęcherza [38]. Czas resekcji i doświadczenie chirurga nie były parametrami wpływającymi na odsetek zwężeń [38]. Zwężenia zespolenia pęcherzowo-cewkowego po prostatektomii radykalnej Według badań odsetek zwężeń zespolenia szyi pęcherza i cewki błoniastej po prostatektomii radykalnej waha się od 1,4% do 29%, z najczęściej raportowanym zakresem 5-10% [39, 40]. Z lepszego uwidocznienia tkanek i precyzyjniejszego wykonania zespolenia przy prostatektomii robotycznej wynikać może niższy obserwowany odsetek zwężeń: 1-3%, należy jednak poaczekać na wyniki długotrwałych obserwacji [41]. Zwężenie jest wynikiem zwłóknienia, którego przyczyną mogą być: zespolenie pod napięciem, nieszczelność zespolenia z zapaleniem indukowanym wyciekiem moczu, traumatyczne preparowanie tkanek oraz niedokrwienie. Czynnikami ryzyka według licznych przeprowadzonych analiz są nadmierne krwawienie, technika preparatyki szyi pęcherza, pooperacyjny wyciek moczu, adjuwantowa radioterapia, uprzednio przeprowadzony zabieg TUR-P, palenie papierosów, starszy wiek, otyłość, jak również brak doświadczenia urologa [39]. Zwężenie najczęściej manifestuje się w okresie 2 lat po chirurgicznym leczeniu radykalnym, podczas gdy po radioterapii nieco później, nawet po okresie 2-5 lat. Wynika to z różnych patomechanizmów indukcji zwłóknienia. W przypadku radioterapii jest wynikiem postępującego zapalenia drobnych naczyń w niedotlenionych tkankach, z następowym wytworzeniem blizny [42]. Odsetek zwężeń cewki tylnej po zastosowanej radioterapii zawiera się w przedziale od 1% do 13%, a po 5 latach obserwacji wzrasta do 10-18% [39, 43]. Zwężenia częściej obserwuje się u pacjentów po przebytym zabiegu TUR-P [43]. Leczenie zwężenia cewki tylnej po TUR-P W przypadku zwężeń szyi pęcherza i części sterczowej cewki rozszerzenia rzadko przynoszą długotrwałe rezultaty, w związku z czym nacięcie szyi pęcherza jest metodą z wyboru [37, 44]. W przypadku zwężeń okolicy zwieracza rozszerzenia, nawet powtarzane, są często najlepszym rozwiązaniem, gdyż bardziej agresywne postępowanie obarczone jest dużym ryzykiem powikłań [36]. Niemniej jednak niektórzy autorzy publikują dobre wyniki rekonstrukcji koniec do końca z nacięciem szyi pęcherza w towarzyszącym zwężeniu proksymalnym [45]. Leczenie zwężenia cewki tylnej po prostatektomii radykalnej Przed planowaniem leczenia bardzo istotna jest ocena jakości tkanek pod kątem zespolenia lub ewentualnej implantacji graftu, ich zdolności regeneracyjnych, jak również warunków anatomicznych: relacji zwężenia do zwieracza zewnętrznego cewki i stopnia „trzymania moczu”. Nie bez znaczenia pozostają zaawansowanie choroby, rokowanie i wiek pacjenta. U wybranej grupy pacjentów optymalnym rozwiązaniem może być nadłonowa cystostomia. Algorytm postępowania w zwężeniach pęcherzowo-cewkowych po przebytej prostatektomii radykalnej zaproponowany przez międzynarodowy panel ekspertów [39] przedstawia schemat 1. Zwężenia po prostatektomii radykalnej pojawiające się wcześnie po zacbiegu (dni - tygodnie po usunięciu cewnika) poddają się często skutecznemu rozszerzeniu. Prawidłowy sposób zakłada założenie prowadnika pod cystoskopową kontrolą wzroku, a następnie kalibrację współosiową, co ogranicza uszkodzenia zespolenia oraz wytworzenie fałszywej drogi [46]. Efekty takiego postępowania przynoszą różne, według niektórych autorów korzystne wyniki odległe [46, 47]. U pacjentów, u których zwężenie pojawia się później lub leczenie rozszerzeniami jest nieskuteczne, zaleca się wykonanie uretrotomii optycznej bądź z użyciem lasera holmowego z intencją zachowania mechanizmu trzymania moczu - oszczędzeniem mięśnia poprzecznie prążkowanego cewki [39, 44]. Opisano różnorakie techniki rozcięcia zwężenia: „zimnym nożem”, laserowe, różne lokalizacje i liczbę nacięć [39]. Rola i skuteczność przerywanego samocewnikowania nie zostały w tej grupie ostatecznie określone. Po nieskuteczności wyżej omówionego leczenia kolejnym etapem jest głębokie nacięcie zwłókniałego pierścienia cewki, z opcją wykorzystania czynników antyproliferacyjnych, jak mitomycyna C [48]. Niesie ono jednak wyższe ryzyko nietrzymania moczu, o czym pacjent musi być poinformowany. Skuteczność takiego postępowania sięga nawet 84% [39]. Alternatywą tego postępowania dla pacjentów obawiających się nietrzymania moczu jest przerywane samocewnikowanie lub implantacja krótkiego stentu. Problemy związane ze stentowaniem, takie jak ryzyko migracji, przerostu tkanki, protruzji, a przy dłuższym stencie ryzyko nietrzymania moczu i następowego jego leczenia powodują, iż jest to rozwiązanie suboptymalne, często czasowe. Ciężkie postacie zwężeń wymagają agresywnej strategii operacyjnej. Różnorodność zastosowanych technik wynika z indywidualnych warunków anatomicznych, tj. długości zwężenia, lokalnej jakości tkanek, uprzednich interwencji chirurgicznych oraz doświadczenia urologa. Ten ostatni parametr wydaje się szczególnie istotny biorąc pod uwagę, iż publikacje dotyczące rekonstrukcji zespolenia po prostatektomii radykalnej opierają się zazwyczaj na kilku przypadkach [39, 49, 50]. Wśród stosowanych technik możliwe są między innymi zespolenie koniec do końca, użycie graftów lub płatów uszypułowanych [39, 49, 50]. W przypadku rozległej blizny i konieczności znacznej mobilizacji cewki przedniej, wielokrotnych uprzednich nacięć endoskopowych oraz osłabienia funkcji zwieracza podczas prostatektomii wzrasta ryzyko nietrzymania moczu po rekonstrukcji zespolenia [39]. 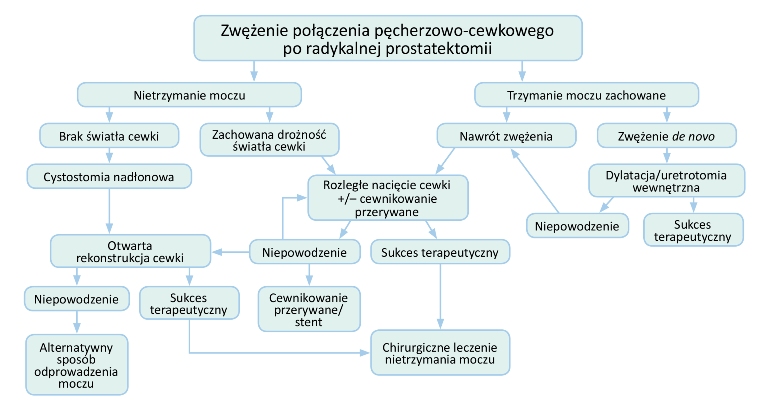
dr n. med. Marta Skrodzka Piśmiennictwo:
|
||||||||
