Opracowano na podstawie: ICUD-EAU International Consultation on Bladder Cancer 2012: Pathology*
MB Amin, JK McKenney, GP Paner, DE Hansel, DJ Grignon, R Montironi, O Lin, M Jorda, LC Jenkins,
M Soloway, JI Epstein, VE Reuter, European Urology 2013; 63(1): 16–35 *ICUD – International Consultation on Urological Diseases; EAU – European Association of Urology
Podstawowa wiedza z zakresu patologii raka pęcherza moczowego wydaje się być niezbędna w codziennej praktyce urologicznej. Jednocześnie pozostaje warunkiem satysfakcjonującej współpracy z patologiem.
Histoanatomia pęcherza moczowego
- Zmiany w obrębie nabłonka urotelialnego (epithelial changes)
- Denudacja nabłonka (urothelial denudation). Przyczyną denudacji może być instrumentacja dróg moczowych, jak i terapia dopęcherzowa. Ogniska denudacji mogą również otaczać ogniska Cis na skutek utraty kohezji komórek, dlatego zawsze powinny być raportowane przez patologa (GR: C)
- Rozrost urotelium (urothelial hyperplasia). Rozrost jest definiowany jako pogrubienie warstwy nabłonka, w którym nie stwierdza się atypii komórkowej. Może przyjmować morfologię rozrostu płaskiego lub brodawkowatego. Zmiany płaskie często towarzyszą ogniskom raka o niskiej złośliwości. Czynnikami różnicującymi z rozrostem nowotworowym pozostają
brak atypii komórkowej oraz rdzeni łącznotkankowych typowych dla brodawczaków.
- Metaplazja płaskonabłonkowa (squamous metaplasia). Obecność nabłonka płaskiego nierogowaciejącego jest stwierdzana w obrębie trójkąta pęcherza moczowego u 75–86% kobiet, co nie stanowi patologii. Jednocześnie obecność
nabłonka płaskiego w każdym innym umiejscowieniu w pęcherzu moczowym definiuje się jako metaplazję. Zazwyczaj jest ona wynikiem przewlekłych czynników drażniących – zapalenia, kamicy, obecności uchyłka, schistosomatozy. Metaplazja płaskonabłonkowa wymaga szczególnej uwagi, gdyż z jednej strony może towarzyszyć ogniskom Cis lub raka inwazyjnego, z drugiej strony jest uważana za stan przedrakowy w odniesieniu do raka płaskonabłonkowego pęcherza moczowego. Raport patologiczny zawsze powinien zawierać informację o obecności metaplazji, uzupełnioną o podstawowe dane (nabłonek rogowaciejący vs nierogowaciejący, jednoogniskowy vs wieloogniskowy) (GR: C). Szczególnej uwagi wymagają pacjenci po urazach rdzenia kręgowego z metaplazją płaskonabłonkową z uwagi na istotnie podwyższone ryzyko rozwoju raka płaskonabłonkowego (GR: C).
- Metaplazja gruczołowa (glandular metaplasia, cystitis glandularis). Stanowi łagodną zmianę proliferacyjną, mogącą wyjątkowo obejmować obecność komórek kubkowych typowych dla jelita (metaplazja jelitowa). Wydaje się, że metaplazja jelitowa wiąże się z ryzykiem rozwoju raka gruczołowego pęcherza moczowego.
- Zmiany reaktywne. Zabiegi diagnostyczne i terapeutyczne u chorych na raka pęcherza moczowego mogą prowadzić do zmian w morfologii urotelium, mylonych nieraz z rozrostem nowotworowym. Z tego powodu klinicyści zawsze powinni informować patologa o dotychczasowym przebiegu leczenia.
- Blaszka właściwa błony śluzowej (lamina propria).
- Urotelialny rak mikroinwazyjny. Nie ustalono dotąd definicji wczesnej inwazji w odniesieniu
do raka urotelialnego. Zaleca się, aby terminu tego używać w sytuacji, gdy komórki nowotworowe przekraczają błonę podstawną jednoogniskowo, co jest widoczne w tylko jednym polu widzenia w dużym powiększeniu i nie sięga dalej niż na 2 mm od błony podstawnej (GR: C).
-
Interpretacja mikroskopowa wczesnej inwazji. Istnieje wiele doniesień o niesatysfakcjonującej
powtarzalności rozpoznań mikroinwazji blaszki właściwej. Z uwagi na znaczną trudność diagnostyczną, w przypadku podejrzenia mikroinwazji zaleca się rozszerzenie diagnostyki mikroskopowej lub konsultację z innym patologiem (GR: C).
- Substaging stopnia T1. Zagadnienie substagingu wciąż pozostaje kontrowersyjne. Identyfikacja
głębokości nacieku w obręb blaszki właściwej nie zawsze jest pewna i nie zawsze możliwa w świetle potencjalnych trudności z orientacją błony podstawnej, fragmentacji preparatu, powtarzalności pomiarów, braku udowodnionej wartości klinicznej. Za granicę stopni pT1a, pT1b i ewentualnie pT1c przyjmuje się warstwę mięśniową błony śluzowej i sploty naczyniowe.
Aktualnie konsensus WHO/ISUP nie rekomenduje substagingu, niemniej patolodzy powinni oceniać stopień inwazji blaszki właściwej
(ogniskowość, zasięg, itp.).
-
Warstwa
mięśniowa błony śluzowej (muscula ris mucosae). Identyfikacja warstwy mięśniowej
śluzówki ma kardynalne znaczenie w stagingu inwazyjnego raka urotelialnego. Typowo przyjmuje
ona obraz smukłych wiązek komórek o morfologii mięśniówki ułożonych w pojedynczych warstwach,
poprzerywanych, rozproszonych lub ciągłych. Różnicowanie komórek warstwy mięśniowej błony śluzowej z komórkami mięśniówki właściwej opiera się na określeniu topografii względem błony podstawnej, co w preparatach z przezcewkowej resekcji nie
zawsze jest możliwe (LE: 3). W wątpliwych przypadkach konieczna jest ponowna biopsja (GR: C)
|
Komórki warstwy mięśniowej błony śluzowej ułożone w kilka Fot. 2. Komórki niskozróżnicowanego raka urotelialnego naciekające
pojedynczych, rozproszonych wiązek komórek. Barwienie hematoksyliną
i eozyną, powiększenie 100 x (materiał własny autora) |
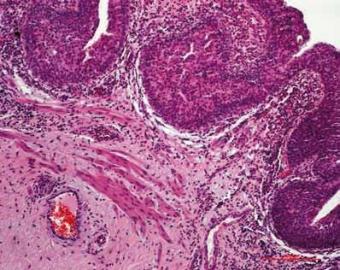 |
|
Komórki niskozróżnicowanego raka urotelialnego naciekające pojedynczych, rozproszonych wiązek komórek. Barwienie hematoksyliną, powiększenie 100 x (materiał własny autora) |
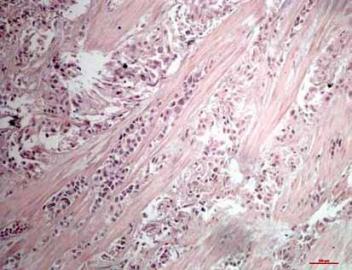 |
-
Mięśniówka właściwa (muscularis propria). W przy padku raka wysokiego ryzyka (high grade) oraz
guzów T1 raport patologiczny zawsze powinien zawierać informację o obecności mięśniówki
w preparacie. W razie braku błony mięśniowej prawidłowy staging jest możliwy dopiero po ponownej resekcji (GR: B). Zaleca się ujednolicenie terminologii i używanie pojęcia ?włókna mięśniówki właściwej? (GR: C). Stopień T2 dzieli się na T2a
i T2b w zależności od głębokości nacieku komórek w mięśniówce, co nie ma praktycznego zastosowania w przypadku stagingu na podstawie preparatów z TURBT, a w preparatach z cystektomii bywa trudne wobec skomplikowanej identyfikacji warstw
histologicznych (LE: 3). Jednocześnie nie zbadano dotąd powtarzalności różnicowania stopni pT2a i pT2b wśród patologów (LE: 4), a dane na temat wartości prognostycznej substagingu stopnia T2 są sprzeczne
-
Tkanka tłuszczowa (adipose tissue). Tkanka tłuszczowa często bywa obecna tak w śluzówce (zazwyczaj skąpa), jak i w mięśniówce (zazwyczaj bogata). Naciekanie tkanki tłuszczowej w preparacie z TURBT nie powinno być więc interpretowane
jako naciekanie tkanki tłuszczowej okołopęcherzowej (T3). Co więcej, różnicowanie tkanki tłuszczowej
obecnej w mięśniówce z tkanką tłuszczową okołopęcherzową bywa trudne, a w konsekwencji różnicowanie pomiędzy stopniami pT2b i pT3a w preparatach z cystektomii może być skomplikowane (LE: 3). Jednocześnie podważa się wartość prognostyczną różnicowania T2b i T3a wobec podobnego ryzyka wznowy, obecności przerzutów węzłowych i śmiertelności. Podobnie istnieje wiele kontrowersji dotyczących klinicznej zasadności substaginu stopnia T3 na T3a i T3b (LE: 4).
Klasyfikacja i ocena zróżnicowania nieinwazyjnego raka urotelialnego pęcherza moczowego (pTa)
W zależności od stosunku do powierzchni śluzówki pęcherza moczowego nienaciekający rak pęcherza moczowego może mieć wzrost płaski, brodawkowaty (egzofityczny) lub odwrócony (endofityczny). Wszystkie trzy typy wzrostu mogą być przy tym obecne w jednym guzie.
-
Zmiany płaskie. Grupa obejmuje dysplazję oraz raka przedinwazyjnego Cis. Dysplazja charakteryzuje
się zaburzeniem architektoniki nabłonka oraz obecnością atypii komórkowej zmiennego nasilenia. Aktualnie dysplazji nie poddaje się gradingowi. Rak przedinwazyjny Cis charakteryzuje się nieładem architektonicznym oraz wyraźną atypią znacznego
stopnia. W 20?30% przypadków obserwuje się progresję do raka naciekającego (LE: 2).
-
Zmiany brodawkowate. W tej grupie zmian wyróżnia się cztery postaci:
-
Brodawczak urotelialny (urothelial papilloma) zbudowany jest z kilku drobnych palczastych
wypustek pokrytych prawidłowym nabłonkiem. Odznacza się niskim ryzykiem wznowy i progresji (LE: 2).
-
Brodawczakowaty nowotwór urotelialny o niskim potencjale złośliwości (pappilary urothelial neo
plasm of low malignant potential – PUNLMP) charakteryzuje się rozrostem komórek urotelium o prawidłowej morfologii na łącznotkankowych rdzeniach. Zmiana wiąże się z istotnie niższym ryzykiem wznowy i progresji w porównaniu z rakiem brodawczakowatym (LE: 2).
-
Rak brodawczakowaty niskiego ryzyka (low gra de papillary carcinoma) obejmuje rozrost komórek urotelium zdradzających cechy atypii niewielkiego stopnia na łącznotkankowych rdzeniach. Charakteryzuje się wyższym ryzykiem progresji w stosunku do PUNLMP, jednocześnie znacznie niższym w stosunku do raka wysokiego ryzyka.
-
Rak brodawczakowaty wysokiego ryzyka (high grade papillary carcinoma) obejmuje rozrost komórek urotelium o nasilonej atypii na łączno tkankowych rdzeniach. Nowotwór ma duży potencjał do wznowy i progresji, często jest wieloogniskowy i współwystępuje z Cis.
-
Zmiany odwrócone. Aktualny system klasyfikacyjny nie obejmuje zmian odwróconych, te są jednak
zwyczajowo wyróżniane. Przy tego typu zmianach rekomenduje się stosowanie tych samych kryteriów diagnostycznych co w przypadku zmian płaskich i egzofitycznych.
Ocena zróżnicowania inwazyjnego raka urotelialnego pęcherza moczowego (pT1 i pT2+)
Rak o niskiej złośliwości (low grade carcinoma) nie ma inwazyjnego potencjału, stąd raki inwazyjne
powinny zawsze być klasyfikowane jako wysokiej złośliwości (high grade) (GR: C).
Warianty raka urotelialnego
Warianty raka urotelialnego stanowią niewielką podgrupę, w części będąc poznanymi jedynie na podstawie opisów małych serii i pojedynczych przypadków.
Rak urotelialny z rozbieżnym zróżnicowaniem (urothelial carcinoma with divergent differentiation)
Rak urotelialny wykazuje skłonność do odróżnicowania komórek, najczęściej w kierunku nabłonka płaskiego i gruczołowego. Rozpoznanie opiera się na obra zie mikroskopowym. W praktyce w raporcie patologicznym zawiera się informacje o odmiennym zróż-
nicowaniu części populacji komórek nowotworowych, podając odsetek komórek objętych procesem. Znaczenie prognostyczne odróżnicowania komórek pozostaje nieznane, w kilku badaniach dowiedziono jednak negatywnego wpływu.
Rak urotelialny mikrobrodawczakowaty (micropapillary variant of urothelial carcinoma)
Rak mikrobrodawczakowaty zbudowany jest z drobnych brodawek podobnych do tych obserwowanych w surowiczych brodawczakowatych nowotworach jajnika. Typowo rozrośnięty nabłonek nie wspiera się na rdzeniach łącznotkankowych, charakterystycznych
dla konwencjonalnego raka urotelialnego. Stwierdzenie ogniska budowy mikrobrodawczakowatej niezależnie od wielkości jego obszaru w pełni uzasadnia rozpoznanie raka mikrobrodawczakowatego, gdyż każda ilość takiego utkania istotnie pogarsza rokowa-
nie, pozostając z nim w dodatniej korelacji. W większości przypadków w chwili rozpoznania nowotwór nacieka mięśniówkę. Z uwagi na złe rokowanie i brak wrażliwości na terapię BCG, w tej grupie pacjentów, niektórzy sugerują radykalną cystektomię w przypadku guzów Ta i T1, przy czym nie jest to postępowanie uniwersalnie akceptowane.
Rak urotelialny z gniazdami (nested variant of urothelial carcinoma)
Wariant typowo obejmuje obecność w obrębie blaszki właściwej drobnych, nieregularnie dystrybuowanych
gniazd komórek urotelium o łagodnej morfologii. Często stwierdza się naciekanie mięśniówki. Rokowanie dla tej grupy pacjentów jest co najmniej tak złe jak w przypadku raka o wysokiej złośliwości.
Rak typu nabłoniaka limfatycznego (lymphoepi-thelioma-like carcinoma)
Ten wariant obejmuje obecność gniazd nisko zróżnicowanych komórek raka urotelialnego, otoczonych
gęstym naciekiem zapalnym. Obraz jest podobny do obrazu nabłoniaka limfatycznego, typowo występującego w regionie głowy i szyi.
Rak mięsakowaty (sarcomatoid carcinoma)
Mięsakorak jest wariantem, w którym obserwuje się obecność zarówno elementów nabłonkowych, jak i komórek wrzecionowatych. Zazwyczaj komórki wrzecionowate wykazują niskie zróżnicowanie i nieokreśloną architekturę, przypominając nieraz złośliwego
guza histocytarnego. Pomimo morfologicznego podobieństwa do mięsaka, nowotwór uważany jest za nabłonkowy, gdyż komórki wrzecionowate różnicują się ze złośliwych komórek nabłonkowych.
Niezróżnicowany rak urotelialny z olbrzymimi komórkami trofoblastycznymi (undifferentiated urothelial carcinoma with trophoblastic giant cells)
Zróżnicowanie w kierunku komórek trofoblastu może być stwierdzone w preparatach raka urotelialnego w dwójnasób:
- na podstawie dodatkowych badań serologicznych lub immunohistochemicznych w obrębie komórek o typowej morfologii raka urotelialnego;
- na podstawie typowego obrazu mikroskopowego dwufazowego guza o budowie właściwej dla raka kosmówki lub guza z obecnością
rozrzuconych komórek olbrzymich pośród komórek urotelium.
W tej grupie chorych czynnikiem, na podstawie którego można wnioskować o odpowiedzi na leczenie, pozostaje immunoreaktywność z ludzką gonadotropiną kosmówkową.
Rak niezróżnicowany, w tym rak olbrzymio komórkowy (undifferentiated carcinoma, giant cell carcinoma)
Jest to grupa obrazów histologicznych zbudowanych z pasm lub izolowanych niezróżnicowanych komórek,
niespełniających kryteriów rozpoznania raka urotelialnego, płaskonabłonkowego, gruczołowego ani żadnego innego. Mimo to, niektórzy autorzy postulują rozpoznawanie w tych przypadkach raka urotelialnego o wysokiej złośliwości, biorąc pod uwagę fakt, że rak urotelialny jest najczęstszym typem histologicznym
w tym umiejscowieniu.
Rak płaskonabłonkowy
Rak płaskonabłonkowy (squamous cell carcino ma) pęcherza moczowego histologicznie zbudowany
jest niemal w całości z rogowaciejącego nabłonka płaskiego. W krajach zachodnich stanowi około 5% nowotworów złośliwych w tym umiejscowieniu. Biorąc pod uwagę stopień zaawansowania choroby, rokowanie pacjentów z rakiem płaskonabłonkowym jest podobne do rokowania pacjentów z rakiem urotelialnym. Niemniej, rak płaskonabłonkowy rozpoznawany
jest zazwyczaj w chwili znacznego zaawansowania. U 24% chorych w chwili rozpoznania stwierdza się
obecność przerzutów węzłowych, zaś przeżycie 5-letnie specyficzne dla nowotworu szacuje się na 57%.
Jednocześnie nowotwór charakteryzuje się ograniczoną chemio- i promienioczułością. W istotnej części przypadków rak płaskonabłonkowy jest związany ze schistosomatozą, inaczej bilharcjozą pęcherza moczowego. Wśród raków płaskonabłonkowych wyróżnia się ponadto rzadko rozpoznawany podtyp brodawkowaty (verrucous carcinoma).
Rak gruczołowy
Pierwotny gruczolakorak (adenocarcinoma) pęcherza moczowego jest zbudowany z komórek o zróżnicowaniu gruczołowym. Wyróżnia się pięć jego podtypów:
- rak jelitowy (enteric) zbudowany z gronek, kosmków lub wykazujący budowę litą;
- rak śluzowy (mucinous) lub koloidowy (colloid) zbudowany z pojedynczych komórek bądź ich gniazd w jeziorach śluzu;
- rak zbudowany z komórek sygnetowatych (signet-ring cell);
- rak gruczołowy niewymieniony gdzie indziej (not otherwise specified ? NOS), będący rozpoznaniem zarezerwowanym dla przypadków raków gruczołowych niespełniających kryteriów wymienionych wyżej trzech typów;
- rak mieszany.
Odsetek przeżyć 5-letnich pacjentów z gruczolakorakiem pęcherza moczowego zawiera się w przedziale
11?55%. Podobnie jak w przypadku raka płaskonabłonkowego, rokowanie wynika głównie ze znacznego
zaawansowania choroby w chwili rozpoznania. Poza stopniem zaawansowania choroby, istotne znaczenie
prognostyczne wydaje się mieć również podtyp histologiczny. Guzy wykazujące utkanie mieszane wiążą
się ze znacznie wyższym przeżyciem (5-letnie – 64%) w porównaniu z guzami śluzowymi (55%), NOS (51%) i zbudowanymi z komórek sygnetowatych (27%).
Rak gruczołowy pęcherza moczowego może wywodzić się z komórek będących pozostałością po moczowniku. Należy przy tym pamiętać, że z pozostałości moczownika mogą rozwijać się również inne typy histologiczne nowotworów pęcherza moczowego, co zdarza
się jednak znacznie rzadziej. Dla identyfikacji guzów wywodzących się z moczownika stosowane są różne kryteria diagnostyczne opracowane niezależnie przez różne grupy badawcze. Najszerzej stosowane są kryteria opracowane przez Wheelera i Hilla:
- obecność guza w szczycie pęcherza;
- wykluczenie zmian o charakterze cystitis cystica i cystitis glandularis;
- przewaga zajęcia mięśniówki nad zajęciem blaszki właściwej błony śluzowej z prawidłowym obrazem nabłonka lub z owrzodzeniami;
- pozostałości moczownika połączone z masą nowotworu;
- obecność masy nowotworowej w okolicy nadłonowej.
Wymienia się ponadto podtyp jasnokomórkowy raka gruczołowego pęcherza moczowego. Rozpoznanie zarezerwowane jest dla guzów w znacznym stopniu przypominających budową histologiczną raki jasnokomórkowe typu Müllera występujące w żeńskim układzie rozrodczym.
Rak neuroendokrynny
Wśród raków neuroendokrynnych (neuroendocrine carcinomas) wyróżnia się dwa podtypy:
- rak drobnokomórkowy,
- rak wielkokomórkowy.
Oba podtypy mogą współwystępować. Rak neuroendokrynny typowo rozpoznawany jest w zaawansowanych stadiach, w 94% na etapie naciekania mięśniówki właściwej lub naciekania pozapęcherzowego. Nierzadko choroba w chwili rozpoznania ma charakter uogólniony.
Oprac.: lek. Sławomir Poletajew
Katedra i Klinika Urologii Ogólnej, Onkologicznej i Czynnościowej
Warszawski Uniwersytet Medyczny
kierownik kliniki: prof. dr hab. n. med. Piotr Radziszewski
