| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
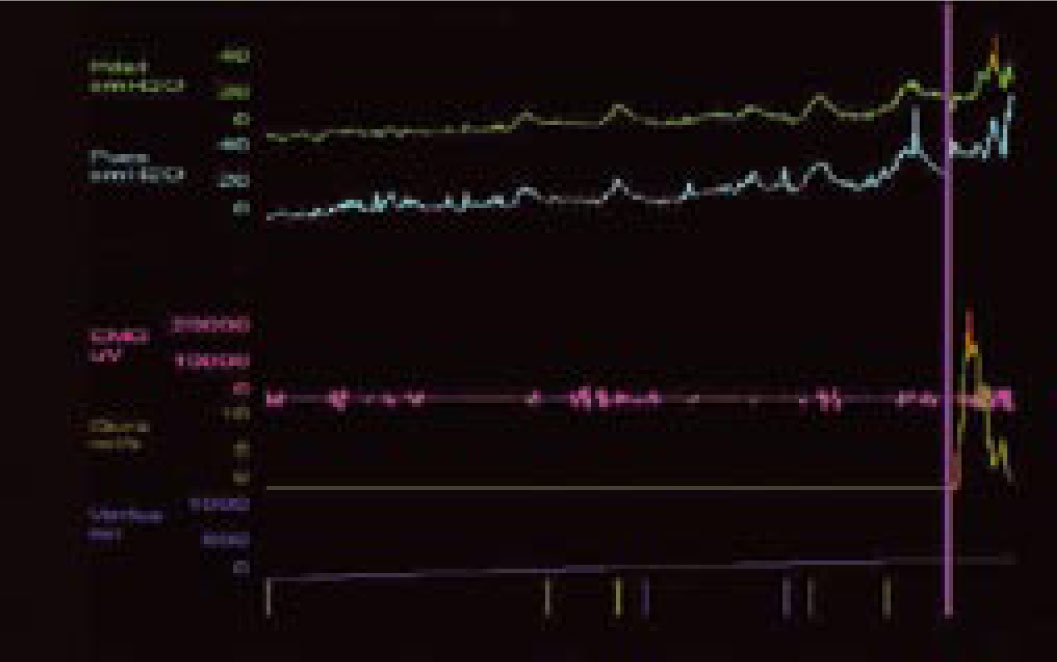
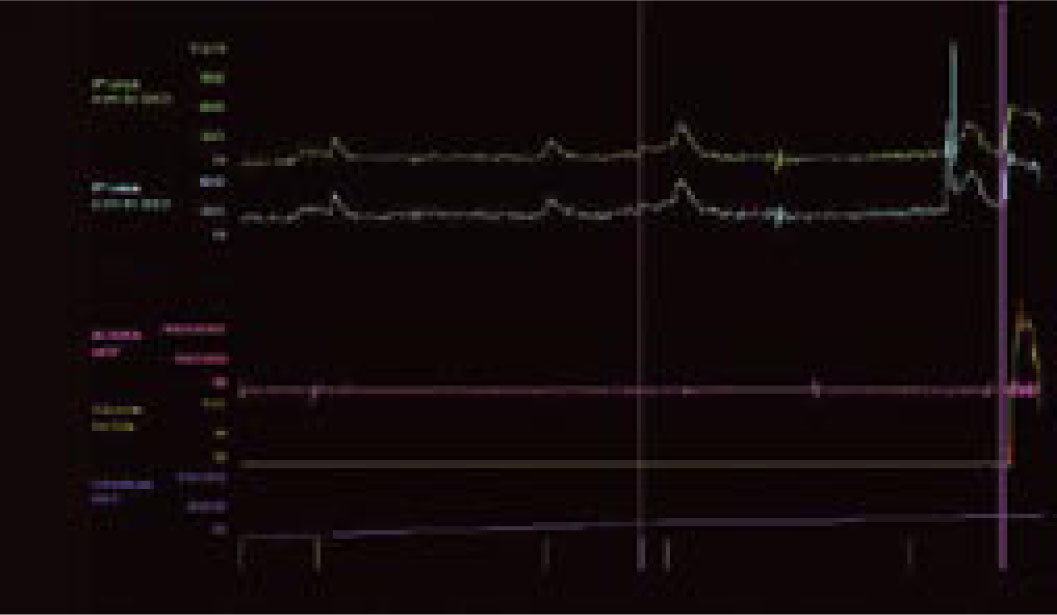
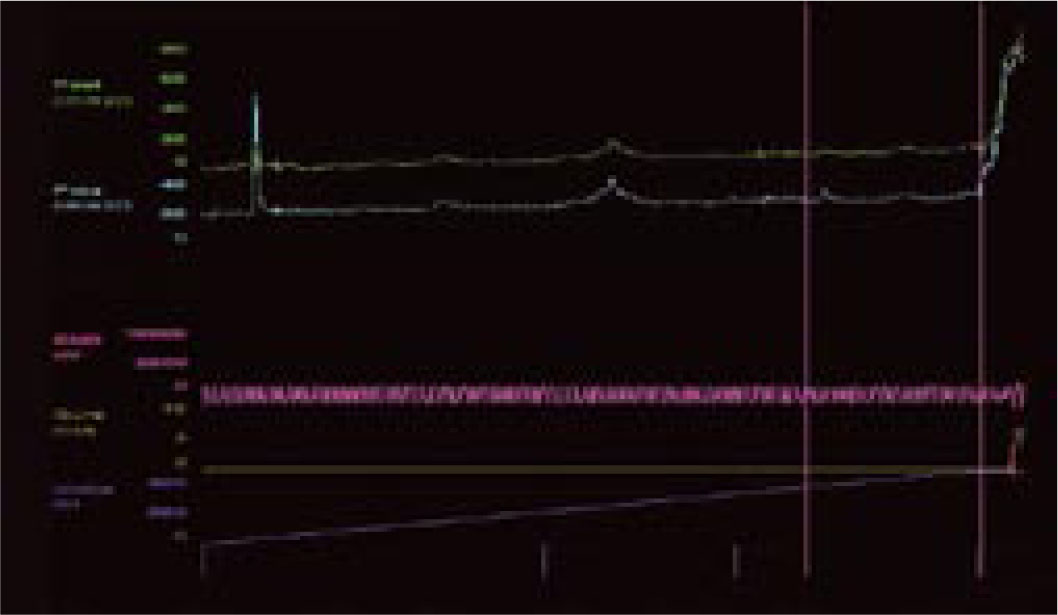
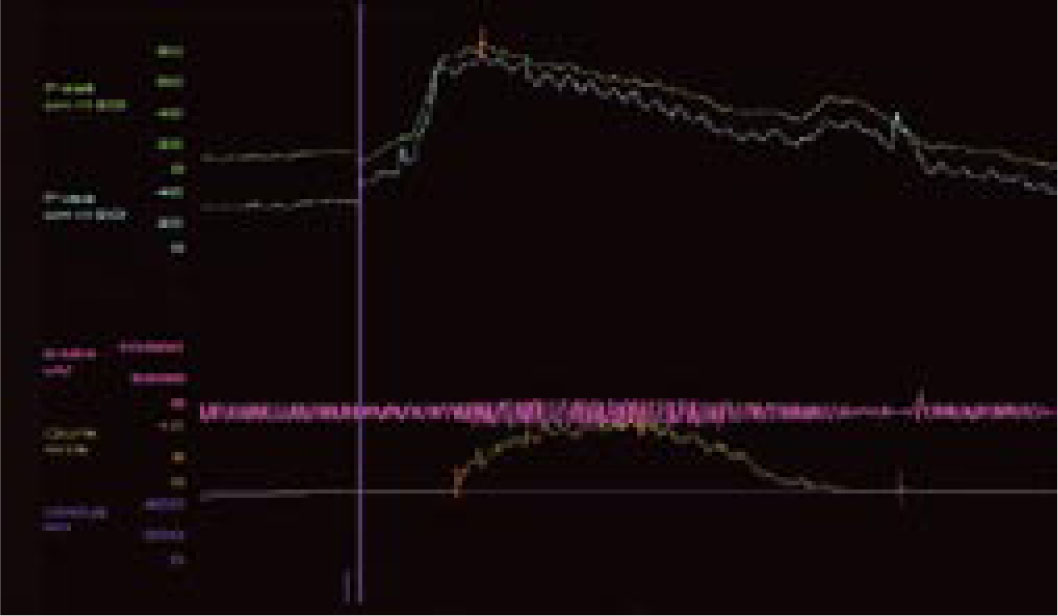
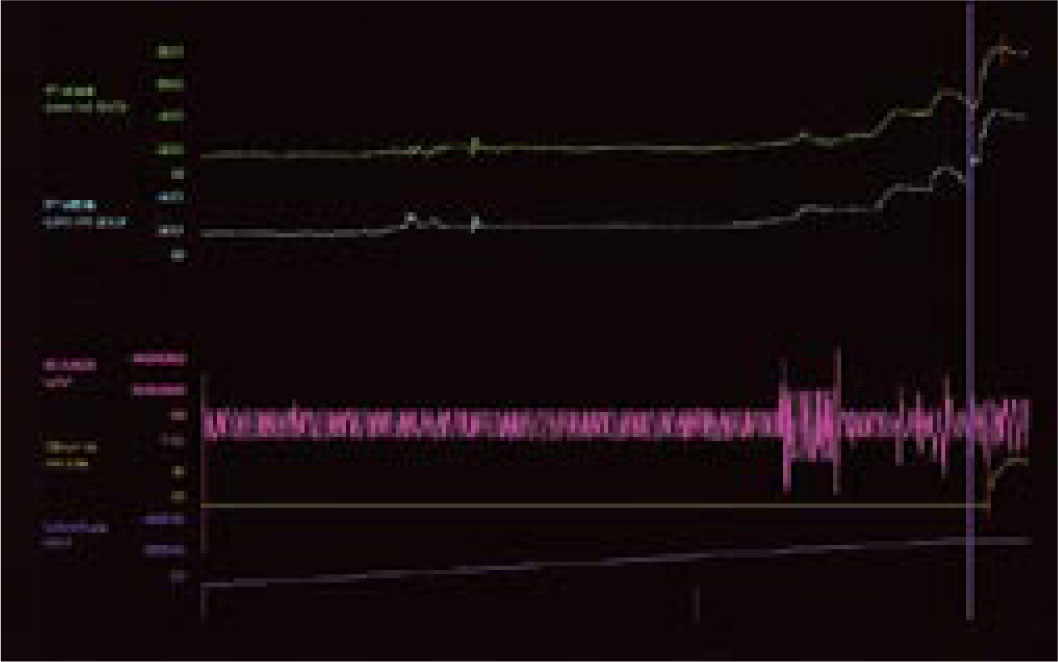
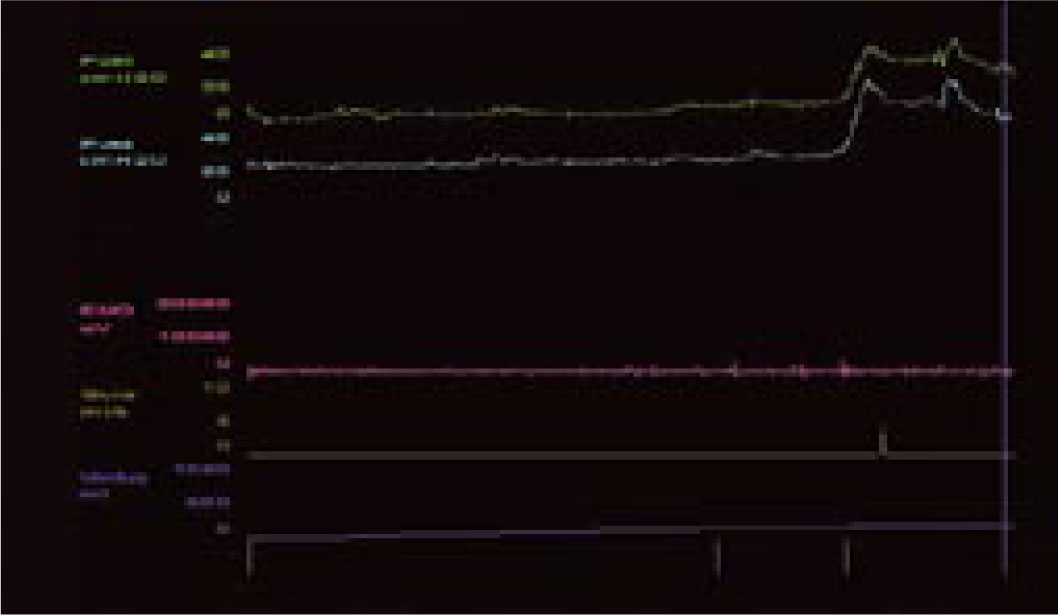
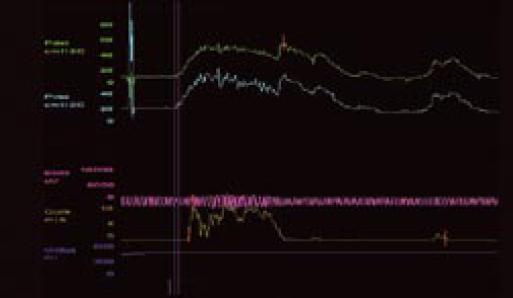
Pęcherz nadreaktywny i naglące nietrzymanie moczu - choroba jednostki czy choroba społeczeństwa. Etiologia i leczenieWe are only as sick as our secrets Niewiele schorzeń budzi u pacjentów uczucie zażenowania w stopniu porównywalnym do nietrzymania moczu, a powyższe motto, będące hasłem przewodnim amerykańskich grup wsparcia, celnie ilustruje ich sytuację. Stosownie do definicji podanej przez International Continence Society (ICS) nietrzymanie moczu to stan, w którym niezależny od woli wyciek moczu jest źródłem istotnych dla chorego problemów higienicznych i socjalnych [1]. Pomimo znacznej dokuczliwości nietrzymania moczu, większość pacjentów godzi się z pogorszeniem jakości życia i ogranicza swą aktywność. Nietrzymanie moczu zyskało miano "choroby przeżywanej w skrytości" (closet disorder), a jedna z jego postaci jest elementem zespołu nadreaktywnego pęcherza (overactive bladder - OAB). W przebiegu OAB zwykle stopniowe nasilenie dolegliwości prowadzi do zmiany stylu życia, pacjenci ograniczają ilość przyjmowanych płynów, starają się nie oddalać od miejsca zamieszkania lub pozostawać w pobliżu toalet [2, 3, 4, 5]. Dwie trzecie pacjentów przyznaje, że jakość ich życia uległa istotnemu pogorszeniu. Wyniki kwestionariuszy oceny jakości życia (quality of life - QoL) pacjentów wykazują, że obniżenie to jest większe niż spadek QoL u chorych z cukrzycą, astmą czy innymi chorobami przewlekłymi [6]. Jedynie objawy choroby zwyrodnieniowej stawów (arthritis) przewyższają częstość objawów nadreaktywności pęcherza [3]. Jest to także jeden z czynników decydujących o przeniesieniu chorych do domów opieki. W USA blisko połowa mieszkańców tych ośrodków ma objawy naglącego nietrzymania moczu [7, 8]. Jak wykazały analizy socjologiczne, nawet w najwyżej rozwiniętych krajach tylko jedna trzecia pacjentów potrafi zwierzyć się z tego problemu lekarzowi, a dwie trzecie szuka pomocy po więcej niż dwu latach trwania dolegliwości. Przyczyną takiego stanu, oprócz niesłusznego uczucia wstydu, jest wiązanie zaburzeń z procesem starzenia oraz mylne przekonanie, że skoro nie dochodzi do uszkodzenia organizmu, leczenie nie jest potrzebne lub jest nieskuteczne [9, 10, 11]. Niestety, pogląd ten spotkać można także wśród części przedstawicieli środowiska medycznego. Tylko 50% pacjentów zwierzających się lekarzowi z trudności w utrzymaniu moczu otrzymuje leczenie farmakologiczne, a jedynie połowa z nich je kontynuuje [2]. Zagadnienie diagnostyki i leczenia różnych postaci nietrzymania moczu będzie narastać, gdyż dotyka znacznego odsetka ludzkości. Szacunkowe dane wskazują, że dotyczy ok. 200 mln ludzi, w tym 7% populacji poniżej 5. r.ż, 1,4% w wieku 15-24 lat i 2,9% w wieku 55-64 lat [12]. Mimowolny wyciek moczu to efekt kilku, często niezwiązanych ze sobą przyczyn i stosownie do nich zostało wyróżnionych pięć głównych postaci tego stanu [12, 13, 14, 15, 16, 17, 18, 19, 20, 21]. 1. Wysiłkowe nietrzymanie moczu - do wycieku moczu dochodzi na skutek niewydolności zwieraczy cewki moczowej i/lub osłabienia mięśni dna miednicy stanowiących podporę pęcherza moczowego. W tej sytuacji nawet niewielki wzrost ciśnienia w jamie brzusznej nie jest równoważony przez mechanizm zwieraczowy i prowadzi do niekontrolowanego wycieku moczu. 2. Nietrzymanie moczu z przepełnienia - do wycieku moczu dochodzi w sytuacji, gdy znaczna ilość moczu przekracza maksymalną pojemność pęcherza moczowego i jego ciśnienie powoduje "przelewanie" moczu przez cewkę moczową. Sytuacja ma miejsce, gdy na skutek przeszkody podpęcherzowej (np. przerost stercza) lub zaburzeń neurologicznych (np. pęcherz neurogenny po urazie rdzenia kręgowego) pęcherz moczowy nie opróżnia się całkowicie w trakcie mikcji, wskutek czego pozostaje w nim niedostateczna wolna objętość dla kolejnych napływających porcji moczu. Zmiany wsteczne w ścianie pęcherza, do których dochodzi na skutek przeszkody podpęcherzowej, prowadzą do nadaktywności wypieracza przy spadku podatności jego ścian. 3. Funkcjonalne nietrzymanie moczu - występuje w sytuacji, gdy z przyczyn fizycznych, psychicznych lub socjalnych pacjent nie ma dostępu do toalety, np. jest długotrwale unieruchomiony. 4. Naglące nietrzymanie moczu - wywołane autonomicznymi, niezależnymi od woli skurczami pęcherza na skutek nadmiernej aktywności jego mięśni gładkich (m. wypieracza). Pacjent odczuwa silną i niepohamowaną potrzebę oddania moczu, często niewspółmierną do stopnia wypełnienia pęcherza. Nadaktywność wypieracza może towarzyszyć patologiom pęcherza moczowego (kamica, zakażenia) lub schorzeniom centralnego układu nerwowego. W części przypadków nie można ustalić przyczyn opisywanego objawu. Naglącemu nietrzymaniu moczu może towarzyszyć częste oddawanie moczu w dzień i w nocy oraz stałe uczucie parcia na mocz niezależnie od wypełnienia pęcherza, ujęte przez ICS jako zespół nadreaktywnego pęcherza. 5. Postać mieszana - łącząca w sobie przyczyny i cechy wysiłkowego oraz naglącego nietrzymania moczu. Oprócz opisanej w pkt. 4 (i częściowo w pkt. 5) postaci nietrzymania moczu, w każdej można ustalić pierwotną przyczynę i w mniejszym lub większym stopniu ją usunąć. Niestety, pomimo postępu neurofizjologiiilepszegopoznaniaanatomiidrógmoczowychnieustalono podłoża naglącego nietrzymania moczu. Pewne światło na istotę choroby rzucają wyniki badań klinicznych. Jej częstość wzrasta z wiekiem, po 75. r.ż. 58% mężczyzn i 68,7% kobiet podaje kłopoty z utrzymaniem moczu [2]. U kobiet 49% przypadków nietrzymania moczu to postać wysiłkowa, 22% postać nagląca, a 29% postać mieszana. Z kolei u mężczyzn 73% przypadków nietrzymania moczu to postać nagląca, 19% mieszana, a tylko 8% wysiłkowa [11, 22]. Objawy pęcherza nadreaktywnego występują w niemal równym stopniu u obu płci, tj. u 15,6% mężczyzn i 17,4% kobiet. Wykazano też, że u 45% pacjentów z naglącym nietrzymaniem moczu dodatkowo występują cechy wysiłkowego nietrzymania moczu [3]. Epidemiologia zespołu pęcherza nadreaktywnego w świetle badań klinicznych Pomimo rosnącej w ostatnich latach liczby publikacji dotyczących czynnościowych zaburzeń dolnych dróg moczowych, zagadnienie nieprawidłowej i nadmiernej aktywności skurczowej pęcherza nie jest nowe. Już w 1921 roku H. Young i D. Davies opisali objawy odpowiadające dzisiejszemu zespołowi pęcherza nadreaktywnego (overactive bladder - OAB). W późniejszych latach C. Hodgkinson, M. Ayers i B. Drukker nazywali taki stan niestabilnością wypieracza (detrusor instability) i zaproponowali użycie badań urodynamicznych celem jego diagnostyki [23, 24]. Dopiero w roku 1997 P. Abrams i A. Wein zaproponowali obecnie przyjętą przez International Continence Society (ICS) definicję charakterystycznych dolegliwości ze strony dolnych dróg moczowych jako zespół pęcherza nadreaktywnego [23]. Zespół pęcherza nadreaktywnego (OAB) to wzmożone, uporczywe, często nagłe, niewspółmierne do wypełnienia pęcherza odczucie potrzeby oddania moczu (parcie naglące), częste oddawanie moczu w ciągu dnia (frequency) i nocy (nocturia), czasami z towarzyszącym naglącym nietrzymaniem moczu (urge incontinence). Zgodnie z kryteriami ICS częstomocz dzienny to więcej niż 8 mikcji w ciągu doby lub stan, gdy okres pomiędzy poszczególnymi mikcjami jest krótszy niż 2 godziny [23, 25]. Z kolei częstomocz nocny to stan, gdy w ciągu nocy dochodzi do więcej niż 3 mikcji. Objawy te mogą wystąpić wtórnie w przebiegu wielu schorzeń dolnych dróg moczowych, jak kamica, nowotwór, zakażenie, przerost gruczołu krokowego, schorzeń neurologicznych prowadzących do upośledzenia ośrodkowego hamowania kurczliwości mięśnia wypieracza pęcherza (tzw. detrusor hyperreflexia), schorzeń ogólnoustrojowych, jak cukrzyca i zaburzenia hormonalne oraz jako uboczny efekt niektórych leków (preparaty moczopędne, opiaty) [6, 23, 26, 27, 28]. Zgodnie z zaleceniami ICS rozpoznanie samej nadreaktywności wypieracza (czyli reakcji mięśni pęcherza na czynnik zewnętrzny) wymaga potwierdzenia badaniem urodynamicznym, natomiast rozpoznanie zespołu pęcherza nadreaktywnego oparte jest na stwierdzeniu w/w objawów klinicznych po wykluczeniu uchwytnych przyczyn (anatomicznych, metabolicznych) podanej wyżej triady objawów [2, 18, 29, 30]. W zespole pęcherza nadreaktywnego do skurczu pęcherza dochodzi już we wczesnej fazie jego wypełniania. Skurcze te występują spontanicznie i u części pacjentów prowadzą do wspomnianego naglącego nietrzymania moczu [18, 23]. Naglące nietrzymanie moczu to mimowolny, niemożliwy do zatrzymania jego wypływ występujący krótko po odczuciu parcia w okolicy pęcherza. Wywołane jest nieadekwatnym do stopnia wypełnienia pęcherza skurczem wypieracza. Objawy pęcherza nadreaktywnego (częstomocz, parcia naglące, naglące nietrzymanie moczu) mogą występować łącznie lub w różnych kombinacjach. Częstość ich występowania analizowano w kilku badaniach klinicznych. Jedno z nich, przeprowadzone metodą ankietową, objęło 16 776 kobiet i mężczyzn powyżej 40. r.ż. z Wielkiej Brytanii, Francji, Hiszpanii, Włoch, Niemiec i Szwecji. 16,6% ankietowanych podało przynajmniej jeden z objawów OAB zgodnych z kryteriami ICS i zostało zakwalifikowanych jako chorzy; najczęstszym objawem był częstomocz, zgłaszany przez 85% chorych, parcia naglące podawało 54%, a nietrzymanie moczu 36% chorych. U połowy chorych dolegliwości utrzymywały się dłużej niż 3 lata. Tylko 60% z nich szukało porady lekarskiej, jedynie 27% było leczonych [2]. Pacjenci zgłaszali się do lekarza głównie z powodu naglącego nietrzymania moczu, a przeciętny okres trwania objawów wynosił 8,5 lat. Po 3 miesiącach od rozpoczęcia leczenia liczba używanych podkładek spadła o jedną czwartą, natomiast w tym samym czasie u nie leczonych wzrosła o 135% [2, 31, 32]. Zbliżone dane uzyskano podczas ankietowego badania TheNational Overactive Bladder Evaluation (NOBLE), przeprowadzonego w USA wśród 11 740 osób [29]. Ze względu na niestałą liczbę objawów i różny stopień ich dokuczliwości wyodrębniono dwie postaci OAB: bez nietrzymania moczu oraz z nietrzymaniem moczu ("dry" i "wet" patients). Do pierwszej grupy zaliczono osoby, u których parcia naglące wystąpiły przynajmniej 4-krotnie w ciągu miesiąca, liczba mikcji w ciągu dnia przekroczyła 8, a charakter dolegliwości wymusił zmianę dotychczasowego trybu życia i ograniczenie aktywności. Druga grupa objęła osoby, u których dodatkowo wystąpiły co najmniej 3 epizody wycieku moczu związane z parciem naglącym i u których wykluczono wysiłkowe lub inne typy nietrzymania moczu. Wbrew do niedawna rozpowszechnionemu poglądowi, iż OAB występuje głównie, lub tylko, u kobiet, jak w badaniu poprzednim wykazano, że w równym stopniu dotyka niezależnie od wieku przedstawicieli obu płci, choć naglące nietrzymanie moczu jest częstsze u kobiet. Statystyki wykazują, że pomimo zbliżonej częstości występowania nadreaktywności pęcherza u obu płci, stosunek leczonych z tego powodu kobiet do leczonych mężczyzn wynosi 4:1. OAB rozpoznano u 16,9% kobiet, z których 55% zakwalifikowano do drugiej grupy. W tym spośród pacjentek w wieku 20-45 lat 11,9% podawało objawy OAB bez nietrzymania moczu, a 15,3% z nietrzymaniem. Częstość naglącego nietrzymania moczu rosła z wiekiem pacjentek, poczynając od 35. roku życia. [8]. Wśród mężczyzn OAB rozpoznano u 16% ankietowanych, z których jedynie 16% zaliczono do grupy z nietrzymaniem moczu; byli to pacjenci po 65. roku życia [3, 23]. Częstsze występowanie postaci "wet" wśród kobiet można tłumaczyć odmienną anatomią oraz zmianami w mięśniach dna miednicy związanymi z wiekiem oraz przebytymi ciążami i porodami. Istotnego udziału czynnika "mięśniowego" dowodzi większy odsetek przypadków naglącego nietrzymania moczu u otyłych pacjentek. W badaniu NOBLE nadaktywność pęcherza z nietrzymaniem moczu występowała ponad dwukrotnie częściej u kobiet z BMI >30 w porównaniu do pacjentek z BMI<24. Inne badania kliniczne potwierdziły te obserwacje. Co więcej, okazało się, że jedynie 23% pacjentów z BMI >30 nie podaje żadnego z objawów nadreaktywności pęcherza [33, 34, 35]. Oba cytowane badania kliniczne dotyczyły dwu odrębnych pod pewnymi względami populacji: "amerykańskiej" i "europejskiej". Zarzut ten nie dotyczy kolejnej analizy. Badanie EPIC objęło 19 000 uczestników w wieku powyżej 18 lat z Kanady, Niemiec, Wielkiej Brytanii, Szwecji Włoch. U 11,8% badanych wykazano objawy OAB i nie stwierdzono różnic w ich występowaniu u obu płci [36]. Wysoki odsetek występowania nadreaktywności pęcherza podany w wyżej cytowanych badaniach może budzić pewne zastrzeżenia. Najmniej wątpliwości budzi z pewnością zgłaszanie przez badane osoby objawów naglącego nietrzymania moczu. Natomiast częstomocz dzienny, na podstawie którego zakwalifikowano największą grupę osób, obarczony jest w dużym stopniu subiektywnością. Trudno w tym przypadku wykluczyć czynniki związane ze zwyczajami danych osób, jak przyjmowanie dużych ilości płynów czy spożycie popularnych napojów zawierających kofeinę. Wśród chorych zgłaszających objawy pęcherza nadreaktywnego znamienny jest wysoki odsetek osób z zaburzeniami depresyjnymi. Jak dowodzi codzienna praktyka, czasami trudno w takich sytuacjach ocenić, które objawy są pierwotne, a które wtórne. Po upływie kilku lat od ogłoszenia wyników wyżej omówionych badań opublikowano rezultaty analiz przeprowadzonych w Finlandii. Jak poprzednio, częstość występowania objawów pęcherza nadreaktywnego analizowano za pomocą ankiet kierowanych do 6000 osób w wieku 18-79 lat. Odpowiedzi uzyskano od 62,4% z nich. Tylko 8% respondentów zakwalifikowano jako osoby z nadreaktywnością pęcherza moczowego. Wśród mężczyzn 6,5% podało objawy nadreaktywności pęcherza moczowego, a po wykluczeniu pacjentów z przerostem gruczołu krokowego odsetek ten zmalał do 5,6%. Z tej grupy 11% zgłaszało naglące nietrzymanie moczu, 23% częstomocz, a 56% nocne oddawanie moczu. Wśród kobiet 9,3% ankietowanych podawało objawy OAB zgodne z kryteriami ICS, z czego naglące nietrzymanie moczu 27%, częstomocz dzienny 38% i 40% częstomocz nocny. Autorzy badania słusznie wskazują, że subiektywność kryteriów oraz ukierunkowany dobór ankietowanych osób (powyżej 40. r.ż.) poprzednich badań wpływały na zawyżenie częstości występowania OAB w populacji [37]. Być może pewne światło na publikowane statystyki rzucą informacje podane w części dotyczącej ekonomicznych uwarunkowań OAB. Czynniki etiologiczne nadreaktywności pęcherza moczowego Przyczyny nadreaktywności pęcherza nie zostały poznane. Pod uwagę brane są zaburzenia neurologiczne związane z centralnym i obwodowym układem nerwowym, zmiany w dolnych drogach moczowych (np. przeszkoda podpęcherzowa, przyczyny mięśniopochodne w wypieraczu), styl życia (siedzący tryb życia, otyłość, dieta - alkohol, kofeina, palenie tytoniu). Podkreślany jest istotny związek czynników psychogennych z nadreaktywnością pęcherza oraz częste współwystępowanie zaburzeń socjologicznych i psychologicznych, zaburzeń snu, lecz trudno ocenić, czy jest to zjawisko wtórne w stosunku do długotrwałych dolegliwości pęcherzowych, czy też mają one wspólne podłoże. Objawy OAB występują 3-krotnie częściej wśród cierpiących na depresję [38, 39, 40, 41, 42, 43, 44]. Wiele badań wykazało, że ryzyko wystąpienia OAB u kobiet otyłych jest 2-krotnie wyższe w porównaniu do kobiet z prawidłową masą ciała, natomiast nie wykazano tej zależności u mężczyzn [3, 46]. Pod uwagę brane są także zmiany neurologiczne analogiczne do objawów pęcherzowych występujących u pacjentów po urazach rdzenia kręgowego lub w przebiegu stwardnienia rozsianego, gdzie dochodzi do nadreaktywności wypieracza przy zmianach powyżej segmentu S2-S4, lub uszkodzeniach mózgu po wylewach, urazach, w chorobie Parkinsona, gdy uszkodzony jest hamujący wpływ ośrodków mózgowych [46, 47, 48, 49]. Najprawdopodobniej, jak w wielu innych schorzeniach, etiologia jest złożona i zespół pęcherza nadreaktywnego jest końcowym wynikiem szeregu odmiennych i nie związanych ze sobą patologii. U podłoża zespołu OAB leżą dwa zjawiska: parcia naglące (wzmożona wrażliwość pęcherza powodująca uczucie potrzeby oddania moczu nawet przy niewielkim wypełnieniu - sensory urgency) oraz nadaktywność wypieracza (skurcze mięśni gładkich wypieracza już podczas wstępnej fazy wypełniania pęcherza) [23]. U pacjentów z nadreaktywnością pęcherza skurcz wypieracza jest niezależny od wypełnienia pęcherza i wymyka się świadomej kontroli - pęcherz staje się nadaktywny. Przyczyny tego zjawiska leżą w mięśniach gładkich pęcherza moczowego (przyczyny miogenne), nieprawidłowościach funkcjonowania włókien nerwowych i ich zakończeń oraz w samym centralnym układzie nerwowym (przyczyny neurogenne). W prawidłowych warunkach opróżnianie pęcherza podlega świadomej kontroli. Przeciętnie, maksymalna objętość pęcherza wynosi 400-600 ml, a odczucie potrzeby mikcji pojawia się dopiero przy wypełnieniu dwóch trzecich tej objętości. W trakcie stopniowego napływu moczu do pęcherza wypieracz ulega zwiotczeniu, a pasma mięśniowe zgrupowane wokół jego szyi oraz cewki moczowej pozostają w stanie stałego skurczu dzięki pobudzeniu przez współczulne włókna nerwowe wychodzące z segmentów Th11-L2 rdzenia kręgowego. Mikcja wymaga koordynacji szeregu zdarzeń zachodzących w obrębie mózgu, rdzenia kręgowego, obwodowego układu nerwowego i dolnych dróg moczowych. W prawidłowych warunkach pęcherz moczowy pozwala na stopniowe gromadzenie moczu bez znacznego wzrostu ciśnienia wewnątrzpęcherzowego. Wypływ moczu (mikcja) jest świadomym aktem zachodzącym pod kontrolą danej osoby - zwieracze cewki moczowej zmniejszają swe napięcie i następuje skurcz wypieracza. Do opróżnienia pęcherza dochodzi dzięki sygnałom z układu przywspółczulnego przekazywanym przez włókna nerwowe z segmentów S2-S4 rdzenia kręgowego, poprzez splot krzyżowy unerwiający dolne drogi moczowe i mięśnie dna miednicy. Powodują one skurcz wypieracza, zwiotczenie szyi pęcherza, zwieraczy cewki moczowej i mięśni dna miednicy. Jednak nawet po maksymalnym wypełnieniu pęcherza skurcz wypieracza może być zahamowany przez zależne od woli sygnały z kory mózgowej. Świadomie zwiększamy także napięcie zewnętrznego zwieracza cewki moczowej. Upośledzenie hamującego wpływu centralnego układu nerwowego zwiększa autonomię mięśni dolnych dróg moczowych, czego wyrazem jest przewaga napięcia nad zwiotczeniem włókien. Dowodzi tego częste występowanie naglącego nietrzymania moczu u kobiet po histerektomii (wiążącej się z uszkodzeniem nerwów miednicznych) [50, 51]. Cukrzyca insulinozależna, której częstym powikłaniem są zmiany zało się, że jedynie 23% pacjentów z BMI >30 nie podaje żadnego z objawów nadreaktywności pęcherza [33, 34, 35]. Oba cytowane badania kliniczne dotyczyły dwu odrębnych pod pewnymi względami populacji: "amerykańskiej" i "europejskiej". Zarzut ten nie dotyczy kolejnej analizy. Badanie EPIC objęło 19 000 uczestników w wieku powyżej 18 lat z Kanady, Niemiec, Wielkiej Brytanii, Szwecji Włoch. U 11,8% badanych wykazano objawy OAB i nie stwierdzono różnic w ich występowaniu u obu płci [36]. Wysoki odsetek występowania nadreaktywności pęcherza podany w wyżej cytowanych badaniach może budzić pewne zastrzeżenia. Najmniej wątpliwości budzi z pewnością zgłaszanie przez badane osoby objawów naglącego nietrzymania moczu. Natomiast częstomocz dzienny, na podstawie którego zakwalifikowano największą grupę osób, obarczony jest w dużym stopniu subiektywnością. Trudno w tym przypadku wykluczyć czynniki związane ze zwyczajami danych osób, jak przyjmowanie dużych ilości płynów czy spożycie popularnych napojów zawierających kofeinę. Wśród chorych zgłaszających objawy pęcherza nadreaktywnego znamienny jest wysoki odsetek osób z zaburzeniami depresyjnymi. Jak dowodzi codzienna praktyka, czasami trudno w takich sytuacjach ocenić, które objawy są pierwotne, a które wtórne. Po upływie kilku lat od ogłoszenia wyników wyżej omówionych badań opublikowano rezultaty analiz przeprowadzonych w Finlandii. Jak poprzednio, częstość występowania objawów pęcherza nadreaktywnego analizowano za pomocą ankiet kierowanych do 6000 osób w wieku 18-79 lat. Odpowiedzi uzyskano od 62,4% z nich. Tylko 8% respondentów zakwalifikowano jako osoby z nadreaktywnością pęcherza moczowego. Wśród mężczyzn 6,5% podało objawy nadreaktywności pęcherza moczowego, a po wykluczeniu pacjentów z przerostem gruczołu krokowego odsetek ten zmalał do 5,6%. Z tej grupy 11% zgłaszało naglące nietrzymanie moczu, 23% częstomocz, a 56% nocne oddawanie moczu. Wśród kobiet 9,3% ankietowanych podawało objawy OAB zgodne z kryteriami ICS, z czego naglące nietrzymanie moczu 27%, częstomocz dzienny 38% i 40% częstomocz nocny. Autorzy badania słusznie wskazują, że subiektywność kryteriów oraz ukierunkowany dobór ankietowanych osób (powyżej 40. r.ż.) poprzednich badań wpływały na zawyżenie częstości występowania OAB w populacji [37]. Być może pewne światło na publikowane statystyki rzucą informacje podane w części dotyczącej ekonomicznych uwarunkowań OAB. Czynniki etiologiczne nadreaktywności pęcherza moczowego Przyczyny nadreaktywności pęcherza nie zostały poznane. Pod uwagę brane są zaburzenia neurologiczne związane z centralnym i obwodowym układem nerwowym, zmiany w dolnych drogach moczowych (np. przeszkoda podpęcherzowa, przyczyny mięśniopochodne w wypieraczu), styl życia (siedzący tryb życia, otyłość, dieta - alkohol, kofeina, palenie tytoniu). Podkreślany jest istotny związek czynników psychogennych z nadreaktywnością pęcherza oraz częste współwystępowanie zaburzeń socjologicznych i psychologicznych, zaburzeń snu, lecz trudno ocenić, czy jest to zjawisko wtórne w stosunku do długotrwałych dolegliwości pęcherzowych, czy też mają one wspólne podłoże. Objawy OAB występują 3-krotnie częściej wśród cierpiących na depresję [38, 39, 40, 41, 42, 43, 44]. Wiele badań wykazało, że ryzyko wystąpienia OAB u kobiet otyłych jest 2-krotnie wyższe w porównaniu do kobiet z prawidłową masą ciała, natomiast nie wykazano tej zależności u mężczyzn [3, 46]. Pod uwagę brane są także zmiany neurologiczne analogiczne do objawów pęcherzowych występujących u pacjentów po urazach rdzenia kręgowego lub w przebiegu stwardnienia rozsianego, gdzie dochodzi do nadreaktywności wypieracza przy zmianach powyżej segmentu S2-S4, lub uszkodzeniach mózgu po wylewach, urazach, w chorobie Parkinsona, gdy uszkodzony jest hamujący wpływ ośrodków mózgowych [46, 47, 48, 49]. Najprawdopodobniej, jak w wielu innych schorzeniach, etiologia jest złożona i zespół pęcherza nadreaktywnego jest końcowym wynikiem szeregu odmiennych i nie związanych ze sobą patologii. U podłoża zespołu OAB leżą dwa zjawiska: parcia naglące (wzmożona wrażliwość pęcherza powodująca uczucie potrzeby oddania moczu nawet przy niewielkim wypełnieniu - sensory urgency) oraz nadaktywność wypieracza (skurcze mięśni gładkich wypieracza już podczas wstępnej fazy wypełniania pęcherza) [23]. U pacjentów z nadreaktywnością pęcherza skurcz wypieracza jest niezależny od wypełnienia pęcherza i wymyka się świadomej kontroli - pęcherz staje się nadaktywny. Przyczyny tego zjawiska leżą w mięśniach gładkich pęcherza moczowego (przyczyny miogenne), nieprawidłowościach funkcjonowania włókien nerwowych i ich zakończeń oraz w samym centralnym układzie nerwowym (przyczyny neurogenne). W prawidłowych warunkach opróżnianie pęcherza podlega świadomej kontroli. Przeciętnie, maksymalna objętość pęcherza wynosi 400-600 ml, a odczucie potrzeby mikcji pojawia się dopiero przy wypełnieniu dwóch trzecich tej objętości. W trakcie stopniowego napływu moczu do pęcherza wypieracz ulega zwiotczeniu, a pasma mięśniowe zgrupowane wokół jego szyi oraz cewki moczowej pozostają w stanie stałego skurczu dzięki pobudzeniu przez współczulne włókna nerwowe wychodzące z segmentów Th11-L2 rdzenia kręgowego. Mikcja wymaga koordynacji szeregu zdarzeń zachodzących w obrębie mózgu, rdzenia kręgowego, obwodowego układu nerwowego i dolnych dróg moczowych. W prawidłowych warunkach pęcherz moczowy pozwala na stopniowe gromadzenie moczu bez znacznego wzrostu ciśnienia wewnątrzpęcherzowego. Wypływ moczu (mikcja) jest świadomym aktem zachodzącym pod kontrolą danej osoby - zwieracze cewki moczowej zmniejszają swe napięcie i następuje skurcz wypieracza. Do opróżnienia pęcherza dochodzi dzięki sygnałom z układu przywspółczulnego przekazywanym przez włókna nerwowe z segmentów S2-S4 rdzenia kręgowego, poprzez splot krzyżowy unerwiający dolne drogi moczowe i mięśnie dna miednicy. Powodują one skurcz wypieracza, zwiotczenie szyi pęcherza, zwieraczy cewki moczowej i mięśni dna miednicy. Jednak nawet po maksymalnym wypełnieniu pęcherza skurcz wypieracza może być zahamowany przez zależne od woli sygnały z kory mózgowej. Świadomie zwiększamy także napięcie zewnętrznego zwieracza cewki moczowej. Upośledzenie hamującego wpływu centralnego układu nerwowego zwiększa autonomię mięśni dolnych dróg moczowych, czego wyrazem jest przewaga napięcia nad zwiotczeniem włókien. Dowodzi tego częste występowanie naglącego nietrzymania moczu u kobiet po histerektomii (wiążącej się z uszkodzeniem nerwów miednicznych) [50, 51]. Cukrzyca insulinozależna, której częstym powikłaniem są zmiany neurologiczne, jest jednym z czynników ryzyka rozwoju zespołu nadreaktywnego pęcherza. Także na skutek długo trwającej przeszkody podpęcherzowej (np. przerost gruczołu krokowego, zwężenie cewki moczowej, choroba szyi pęcherza) dochodzi do zaburzeń czynności i struktury ściany pęcherza [52]. Przeszkoda taka prowadzi do wzrostu oporu cewkowego i ciśnienia wewnątrzpęcherzowego. Dochodzi do przerostu i przebudowy struktury mięśnia wypieracza, zmian w komórkach mięśniowych gładkich i połączeniach międzykomórkowych. Obniża się próg pobudliwości komórek mięśniowych z jednoczesnym wzrostem szybkości przekazywania sygnałów pomiędzy poszczególnymi włóknami. Nieprawidłowa aktywność komórek mięśniowych prowadzi do nieskoordynowanych i wzmożonych skurczów grup włókien wypieracza (micromotions), wzrostu częstotliwości mimowolnych skurczów wypieracza (bladder instability) i pobudzania receptorów czuciowych zlokalizowanych w ścianie pęcherza (aferentnych typu C). Rezultatem tych zjawisk są odczuwane przez pacjenta mimowolne skurcze wypieracza, parcia naglące oraz bolesność w okolicy pęcherza już we wczesnych fazach wypełniania. Izolowane zmiany w błonie mięśniowej również mogą prowadzić do wystąpienia objawów OAB. Miocyty gładkie wypieracza pobrane od osób chorych cechują się spontaniczną aktywnością skurczową, podwyższoną wrażliwością na mediatory, zmianami funkcjonowania błonowych kanałów wapniowych i potasowych. Wykazano, że średnia grubość ściany pęcherza moczowego u kobiet z nadreaktywnością pęcherza jest większa niż u kobiet z wysiłkowym nietrzymaniem moczu [53]. Do opisanych zaburzeń układu i funkcji włókien mięśniowych gładkich dołączają zmiany związane z wiekiem, wpływające na czynność pęcherza moczowego: wzrost ilości tkanki łącznej, niedokrwienie oraz u kobiet spadek poziomu estrogenów. Istotnej roli zaburzeń mięśni gładkich wypieracza w rozwoju nadreaktywności pęcherza dowodzi poprawa parametrów oddawania moczu oraz złagodzenie objawów związanych z przerostem stercza u pacjentów, u których oprócz standardowego leczenia blokerami receptorów alfa1-adrenergicznych dodatkowo włączono leki antycholinergiczne. Na przykład w wieloośrodkowym randomizowanym badaniu CombAT (Combination of Avodart and Tamsulosin) u pacjentów z przerostem gruczołu krokowego zastosowano dutasteryd oraz tamsulosynę. Po 24 miesiącach terapii łączonej uzyskano istotną statystycznie poprawę, redukcję objawów związanych z nad-reaktywnością wypieracza, objawów podrażnieniowych i spadek objętości moczu zalegającego w porównaniu do pacjentów stosujących monoterapię. Co więcej, w badaniu tym stwierdzono, że monoterapia lekiem antycholinergicznym była równie skuteczna jak monoterapia alfa-blokerem w łagodzeniu objawów związanych z przerostem gruczołu krokowego [54]. Szereg substancji neuroprzekaźnikowych, aktywnych w centralnym układzie nerwowym, wykazuje istotny wpływ na czynność dolnych dróg moczowych. Dominującym przekaźnikiem jest acetylocholina. Uwalniana z zakończeń nerwów przywspółczulnych za pośrednictwem receptorów muskarynowych (M1, M2, M3, M4, M5), powoduje szereg zmian wewnątrz komórek mięśniowych gładkich. Po ich pobudzeniu z magazynów w siateczce endoplazmatycznej zostają uwolnione jony wapnia, czego skutkiem jest skurcz włókien mięśniowych wypieracza. Zaburzenie czynności tych receptorów prowadzi do nadmiernej pobudliwości skurczowej, niewspółmiernej do stopnia stymulacji receptora i w efekcie do nieskoordynowanych skurczów poszczególnych włókien. Najważniejszymi dla czynności pęcherza moczowego rodzajami receptorów muskarynowych są podtypy M2 i M3. W warunkach prawidłowych przeważa podtyp M3, natomiast w nadreaktywności wypieracza stwierdzana jest wzmożona ekspresja receptora M2. Kolejnym istotnym przekaźnikiem jest dopamina, która poprzez oddziaływanie na receptory D1 zmniejsza aktywność wypieracza, a za pośrednictwem receptorów D2 pobudza jego skurcz. Na czynność pęcherza moczowego w większym lub mniejszym stopniu wpływa szereg innych neuroprzekaźników, np. serotonina (powodująca zwiotczenie mięśni) czy kwas glutaminowy (powodujący pobudzenie skurczów). Podkreślana jest też rola tlenku azotu (NO) w utrzymaniu prawidłowego napięcia włókien mięśniowych wypieracza, analogicznie do roli, jaką NO pełni w utrzymaniu prawidłowej czynności ciał jamistych. Oprócz czynników wewnątrzustrojowych na stan i czynność, w tym kurczliwość, ścian pęcherza moczowego wpływa środowisko zewnętrzne. Skład chemiczny moczu, z którym styka się nabłonek pęcherza moczowego, ulega zmianom zależnie od stopnia nawodnienia organizmu czy też przyjmowanych pokarmów. Jak w przypadku śródmiąższowego zapalenia pęcherza moczowego, wysokie stężenie jonów potasowych czy też kwaśny odczyn moczu powodują nasilenie objawów choroby. Prawdopodobną przyczyną tego zjawiska jest uwalnianie acetylocholiny bezpośrednio z nabłonka przejściowego i/lub nadmierna stymulacja zakończeń czuciowych zlokalizowanych w jego bezpośrednim sąsiedztwie. Oprócz tego urothelium uwalnia szereg innych przekaźników, jak ATP, NO [55, 56, 57, 58]. Część objawów ze strony dolnych dróg moczowych (LUTS) pojawiających się w przebiegu przerostu gruczołu krokowego przypomina objawy nadreaktywności pęcherza moczowego. Stan taki występuje u 50-75% pacjentów z przeszkodą podpęcherzową [59]. Chory odczuwa parcia naglące, skarży się na częstomocz dzienny i nocny, częste jest naglące nietrzymanie moczu. Jednak mężczyźni, w przeciwieństwie do kobiet, rzadziej otrzymują odpowiednie leczenie. Miejsce i rola badania urodynamicznego w diagnostyce pęcherza nadreaktywnego W nowoczesnej urologii dysponujemy aparaturą do badań urodynamicznych i wideourodynamicznych, umożliwiającą badanie pęcherza moczowego w fazie wypełniania i opróżniania. Badanie urodynamiczne pozwala potwierdzić nadreaktywne skurcze wypieracza. Wówczas objawowe rozpoznanie pęcherza nadreaktywnego (OAB) zmienia się w rozpoznanie nadreaktywności wypieracza (OAD), czyli w obiektywnie stwierdzaną i potwierdzoną badaniem patologię. U 50% pacjentów z rozpoznaniem pęcherza nadreaktywnego obserwuje się później nadreaktywne skurcze wypieracza w badaniu urodynamicznym. Kwestia etapu, na którym badanie powinno być wykonane, nie jest rozstrzygnięta. Brak wytycznych dotyczących niezbędności badania urodynamicznego w procesie diagnostycznym u pacjentów z rozpoznanym pęcherzem nadreaktywnym. Przed badaniem urodynamicznym należy wykluczyć infekcję dróg moczowych będącą przeciwwskazaniem do jego wykonania. Pacjent powinien być poinformowany o celu badania i ogólnym jego przebiegu, tak by nie budziło w nich strachu, a wynik był obiektywny. Lekarz prowadzący powinien kierować pacjenta do pracowni urodynamicznej z konkretnym pytaniem. Na badanie pacjent zgłasza się bez specjalnego przygotowania. Obowiązkowa jest higiena narządów płciowych i okolicy krocza. Ważne jest dostarczenie przez pacjenta dotychczasowej dokumentacji medycznej oraz informacji o przyjmowanych lekach, gdyż wiele z nich może wpływać na zaburzenia zarówno fazy wypełniania, jak i fazy wydalania. Badanie urodynamiczne powinno rozpoczynać się od spontanicznej urofluometrii, jednak wydaje się, że pominięcie tego etapu na korzyść wcześniejszego wykonania przynajmniej 2-3 badań urofluometrycznych i wybranie spośród nich najlepszego jest znacznie bardziej obiektywne. Podobnie należy postąpić z oceną zalegania moczu po mikcji spontanicznej. Dobra praktyka urodynamiczna wymaga używania odpowiedniego mianownictwa stosownie do zaleceń ICS. Opis powinien być spójny z urodynamiczną klasyfikacją zaburzeń czynności dolnych dróg moczowych i zawierać odpowiedź na postawione przez lekarza kierującego pytanie oraz sugestię dotyczącą dalszego postępowania. Badanie w fazie wypełniania (cystometria) pozwala na ocenę czynności wypieracza, czucia pęcherzowego, pojemności czynnościowej, podatności ścian i czynności cewki moczowej. Ten etap badania jest kluczowy dla rozpoznania pęcherza nadreaktywnego i nadreaktywności wypieracza. Jeżeli nie zaobserwowano nadreaktywnych skurczów wypieracza, wówczas mówimy o pęcherzu stabilnym. W przypadku stwierdzenia nadreaktywnych skurczów wypieracza możemy rozróżnić nadreaktywność fazową lub terminalną. Wzrost ciśnienia wypieracza odczuwany przez chorego jako parcie na mocz jest nazywany nadaktywnością wypieracza. Gdy u pacjenta stwierdza się odchylenia w badaniu neurologicznym, mówimy o nadreaktywności neurogennej, w przeciwnym wypadku rozpoznajemy postać idiopatyczną. Nadreaktywne skurcze wypieracza obserwuje się u pacjentów w przebiegu zaawansowanej przeszkody podpęcherzowej. W drugim etapie badania urodynamicznego ocenie podlega faza wydalania (mikcji), podczas której istotne są panujące ciśnienia, czynność wypieracza, czynność cewki moczowej oraz synergia pomiędzy czynnością zwieracza i wypieracza. Również w tej części badania, zwłaszcza po zakończeniu mikcji, mogą wystąpić nadreaktywne skurcze wypieracza. Poniższe przykłady pochodzą ze zbiorów własnych i przedstawiają przypadki chorych, u których nadaktywność wypieracza potwierdzono badaniem urodynamicznym.
Badanie urodynamiczne pomaga w rozpoznaniu nadreaktywności wypieracza pęcherza moczowego. Jest niezbędne u chorych kwalifikowanych doleczenia operacyjnego, u pacjentów, u których dotychczasowe leczenie nie przyniosło poprawy oraz w przypadku schorzeń neurologicznych. Możliwości terapii pęcherza nadreaktywnego Pierwsza wizyta pacjenta cierpiącego na OAB u urologa z reguły ma charakterystyczny przebieg. Chory opisuje kilkuletni okres leczenia dolegliwości u lekarza rodzinnego, ogólnego lub lekarzy innych specjalności, poparty długą listą dotychczas przyjmowanych leków. Częstokroć pacjent "wypróbował" niemal wszystkie dostępne antybiotyki, gdyż, ze względu na objawy, dolegliwości traktowane były jako objaw zakażenia dolnych dróg moczowych. Niestety, także dla urologa leczenie nadreaktywności pęcherza nie jest łatwe i często po początkowym sukcesie następuje nawrót dolegliwości. W terapii OAB stosowane są trzy grupy metod leczenia: metody fizykalne, farmakoterapia przy użyciu różnych typów leków oraz metody chirurgiczne.
Metody fizykalne Jednocześnie chory uczy się świadomej kontroli wypieracza oraz zwieracza cewki. Trening prowadzi do wypracowania mechanizmu, dzięki któremu impulsy korowe pozwalają na hamowanie skurczów wypieracza, stymulują napięcie zwieracza cewki moczowej, modulują dośrodkowe włókna czuciowe [63, 64, 65, 66, 67, 68, 69]. Dodatkowym elementem są zalecenia obejmujące ograniczenie przyjmowania napojów zawierających kofeinę, alkohol oraz zmniejszenie ilości płynów przyjmowanych przed nocnym spoczynkiem [70, 71, 72, 73, 74, 75]. Według części autorów terapia behawioralna znajduje zastosowanie jako leczenie wspomagające farmakoterapię, lecz wyniki badań klinicznych są niejednoznaczne [76)]. W jednym z nich 416 pacjentów nieskutecznie leczonych lekiem antycholiner-gicznym (tolterodyną) uczono zasad terapii behawioralnej (zmiany diety, sposoby ćwiczeń mięśni dna miednicy, regulacji mikcji itp.). W przeprowadzonych po 2 miesiącach ankietach kontrolnych 91% pacjentów potwierdzało poprawę stanu zdrowia i złagodzenie objawów związanych z nadreaktywnością pęcherza [77]. Wyniki innych badań nie wykazały tak dobrych rezultatów. Po dołączeniu terapii behawioralnej do stosowanej dotychczas u kobiet z naglącym nietrzymaniem moczu oksybutyniny i darifenacyny nie uzyskano istotnej poprawy w odniesieniu do monoterapii tymi preparatami [78, 79]. Urinary Incontinence Treatment Network na podstawie analizy uzyskanych danych stwierdziło, że dołączenie terapii behawioralnych nie zezwala na odstawienie leków antycholinergicznych [80]. Biofeedback polega na wyćwiczeniu świadomej kontroli nad czynnością narządów działających dotychczas autonomicznie. W przeciwieństwie do wyżej opisanych metod treningowych pacjent obserwuje reakcje swego organizmu przy użyciu odpowiednich urządzeń monitorujących. W przypadku pęcherza nadreaktywnego pacjent uczy się rozpoznawać sygnały poprzedzające, np. epizod naglącego nietrzymania moczu, kontrolować napięcie mięśni dna miednicy, utrzymywać odpowiedni odstęp czasu pomiędzy mikcjami i korzystać z toalety w określonym czasie (toileting assistance). Ćwiczenia te wspomagane są obserwacją przez ćwiczące pacjentki wskazań manometru dopochwowego lub zapisu z elektromiografu. Publikowane wyniki randomizowanych badań wskazują, że skuteczność prawidłowo prowadzonej terapii biofeedback może być porównywalna do wyników leczenia farmakologicznego [81, 82, 83, 84, 85, 86]. Stymulacja mięśni dna miednicy była pierwotnie stosowana w leczeniu wysiłkowego nietrzymania moczu u kobiet. Odpowiednie elektrody (stymulacja elektryczna) zostają umieszczone dopochwowo, przezskórne lub doodbytniczo, a generowany przez nie impuls pobudza mięśnie dna miednicy do skurczów. Mięśnie stopniowo zwiększają swe napięcie i siłę, podobnie jak każdy mięsień szkieletowy poddany stałym obciążeniom. Generowane impulsy elektryczne wpływają także na czynność nerwów biegnących w miednicy mniejszej, powodując zahamowanie przewodnictwa ("porażenie") włókien ruchowych i czuciowych biegnących w nerwach podbrzusznych i sromowych. Zjawisko to uzasadnia zastosowanie powyższej metody do leczenia zespołu pęcherza nadreaktywnego. Bardziej inwazyjny sposób elektrostymulacji polega na wszczepieniu stymulatorów z elektrodami zakończonymi w okolicach nerwów krzyżowych S2-S4, używanych do leczenia zaburzeń pęcherza neurogennego po urazach rdzenia kręgowego. Inne rozwiązanie to neuromodulacja polegająca na bezpośredniej stymulacji elektrodami włókien nerwowych typu A-d w korzeniach S3-S4 prądem o niskiej amplitudzie wytwarzanym przez wszczepiony stymulator (InterStim firmy Medtronic). Stymulacja taka prowadzi do obniżenia poziomu progu reaktywności ściany pęcherza moczowego i jednocześnie wzrostu napięcia zwieracza cewki moczowej [87]. Dla terapii OAB wykorzystano hamowanie skurczów wypieracza po elektrostymulacji obwodowych włókien eferentnych, jak i zahamowanie przewodnictwa w drogach rdzeniowych w efekcie elektrostymulacji włókien aferentnych. W ostatnich latach do stymulacji mięśni dna miednicy oraz nerwów miednicznych wprowadzane są urządzenia wytwarzające pole magnetyczne (stymulacja magnetyczna). Trudno ocenić użyteczność tych metod, gdyż wyniki publikowanych badań klinicznych są niejednoznaczne [88, 89, 90, 91, 92].
Leczenie farmakologiczne nadreaktywności
pęcherza moczowego Lekami z wyboru są preparaty z grupy leków antycholinergicznych, blokujące receptory muskarynowe. Tą drogą zmniejszają autonomiczne skurcze wypieracza, przynajmniej częściowo łagodząc objawy i zmniejszając liczbę epizodów nietrzymania moczu [93, 94, 95]. Dostępnych jest kilka substancji blokujących receptory muskarynowe (np. darifenacyna, hyoscyamina, oksybutynina, tolterodyna, solifenacyna, trospium), lecz brak preparatów o całkowicie wybiórczym blokowaniu receptorów muskarynowych w ścianie pęcherza. Dlatego ubocznym efektem ich działania jest hamowanie (w różnym stopniu w zależności od rodzaju preparatu) wydzielania śliny, powodujące dokuczliwe uczucie suchości w jamie ustnej, zaburzenia widzenia, zaparcia, uczucie senności. Leki antycholinergiczne mogą nasilać objawy demencji. Stosowane jako monoterapia mogą nasilać zaburzenia oddawania moczu u mężczyzn z przerostem gruczołu krokowego. Przeciwwskazaniem do ich dostosowania jest jaskra z wąskim kątem przesączania. Oksybutynina była pierwszym lekiem z tej grupy wprowadzonym do leczenia nadreaktywności pęcherza. Jednak nie wykazuje wybiórczości działania, a efekt hamujący jest nawet silniej wyrażony w stosunku do tkanek gruczołów ślinowych niż pęcherza. Kolejne wprowadzone na rynek preparaty (m.in. tolterodyna, solifenacyna, darifenacyna) cechuje większa wybiórczość w stosunku do receptorów M3 (najwyższą cechuje się darifenacyna). Dotychczas w żadnym z badań klinicznych nie wykazano wyższej skuteczności żadnego z preparatów nad pozostałymi z tej grupy. Najwyższą wybiórczość w stosunku do receptora M2 wykazuje trospium. Wyjątkowa struktura chemiczna (wielkocząsteczkowa czwartorzędowa amina) powoduje, że w minimalnym stopniu przechodzi przez barierę krew-mózg i może być bezpiecznie stosowana u starszych osób. Na następnej stronie (tab. 1) przedstawiono dostępne w Polsce preparaty antycholinergiczne, z uwzględnieniem ich charakterystyki farmakologicznej i klinicznej. Zgodnie z wytycznymi ICI (International Consultations on Incontinence) solifenacyna ma najwyższy stopień referencyjności 1A (wg wytycznych oksfordzkich: 1 - w oparciu o przeglądy systematyczne, metaanalizy, dobrej jakości randomizowane badania kliniczne; A - lek najbardziej rekomendowany). W przypadku solifenacyny nie jest konieczne (tak jak dla oksybutyniny i tolterodyny) opracowywanie form o powolnym uwalnianiu, z uwagi na jej długi okres półtrwania, wynoszący 52 godziny, i czas osiągnięcia maksymalnego stężenia w surowicy krwi wynoszący 3-8 godzin. Wyniki badań klinicznych, zarówno z placebo, jak i z aktywnym komparatorem, wykazują, że solifenacyna jest substancją o wysokim profiluskuteczność/bezpieczeństwo. Roczny okres terapii solifenacyną został ukończony przez 81,4% pacjentów, odsetek pacjentów, którzy zrezygnowali z leczenia z powodu braku skuteczności, wyniósł jedynie 4,8%. Taki sam odsetek pacjentów zrezygnował z leczenia z powodu objawów ubocznych. W indywidualnych ocenach skuteczności leczenia przez pacjentów 74% oceniło ją jako satysfakcjonującą i wyższą, a tylko 1,3% pacjentów oceniło objawy uboczne związane z przyjmowanym lekiem jako nie do zaakceptowania. Kolejne badania kliniczne wykazały, że solifenacyna zmniejsza o 100% liczbę epizodów nietrzymania moczu z parcia, o 60-70% liczbę epizodów parć naglących oraz o 50% liczbę epizodów częstomoczu nocnego. Po leczeniu solifenacyną zupełne ustąpienie objawów nietrzymania moczu było stwierdzane przez 52% pacjentów. Najnowsze badanie kliniczne oceniające solifenacynę w aspekcie wpływu na parcie naglące (jako przyczynę pierwotną wystąpienia innych objawów pęcherza nadreaktywnego) z użyciem 4-stopniowej skali intensywności parcia naglącego PPIUS (Patent Perceptron of Intensity of Urgency Scale), gdzie "0" oznacza brak parcia naglącego, a "4" oznacza nietrzymanie moczu, wykazało, że liczba epizodów parcia naglącego ocenianego na 3 lub 4 po terapii solifenacyną zmniejszyła się średnio o 2,58 punktu, podczas gdy w grupie stosującej placebo tylko o 1,81, co jest wartością znamienną statystycznie (p<0,0001). Wtórną zmienną uwzględnioną w badaniu było postrzeganie choroby jako "problemu", a także miara skrępowania i udręczenia spowodowanego każdym epizodem parcia naglącego. Wykorzystując wzrokową skalę analogową (Visual Analogue Scale), gdzie 0 oznacza "brak niedogodności", a 100 oznacza "najgorszą możliwą niedogodność", po zostosowaniu solifenacyny niedogodności związane parciem naglącym zostały zredukowane o 35 punktów na wspomnianej skali i o 25 w przypadku placebo, co jest wartością znamienną statystycznie (p<0,0001). Potwierdzono również istniejące dane dotyczące profilu bezpieczeństwa solifenacyny - liczba pacjentów, którzy wycofali się z badania z powodu niepożądanych działań ubocznych wyniosła mniej niż 3%. Częstość występowania suchości ust wynosiła 12,2% dla solifenacyny w dawce 5 mg (15,8% solifenacyna 5 i 10 mg), a zaparcia zgłaszało 5% stosujących tę substancję (6,9% solifenacyna 5 i 10 mg). Nie stwierdzono natomiast istotnej różnicy pomiędzy solifenacyną i placebo w częstości zgłaszanych zaburzeń widzenia. Podane wyniki są zgodne z wcześniejszymi badaniami klinicznymi dotyczącymi solifenacyny. Inne preparaty antycholinergiczne mają znacznie gorszy profilskuteczności i tolerancji w porównaniu z solifenacyną. Oprócz preparatów antycholinergicznych w terapii OAB znalazło zastosowanie kilka innych grup leków, przeważnie wówczas, gdy nie uzyskano poprawy po dotychczasowych metodach leczenia lub objawy uboczne nie są akceptowane przez pacjentów. Jednymi z nich są trójpierścieniowe leki przeciwdepresyjne, głównie imipramina oraz rzadziej doxepina. Imipramina pierwotnie stosowana była w leczeniu schizofrenii. Ponieważ wpływa na metabolizm wielu neuroprzekaźników, znalazła zastosowanie w leczeniu szeregu innych zaburzeń psychicznych (np. depresji, zaburzeń afektywnych) i fizycznych (jak moczenie nocne, przewlekłe zespoły bólowe). Hamuje wychwyt zwrotny serotoniny, noradrenaliny, dopaminy, blokuje receptory muskarynowe M2, histaminowe H1, zwiększa ekspresję czynnika wzrostu nerwów - neurotrofiny BDNF (Brain Derived Neurotrophic Factor) obecnej m.in. w neuronach motorycznych, śliniankach i dolnych drogach moczowych. Działa także przeciwbólowo, pobudzając receptory opiatowe typu "mi". Ze względu na wyżej opisane właściwości, u chorych z nadreaktywnością pęcherza zmniejsza dolegliwości związane z parciami naglącymi, bólami w okolicy nadłonowej, jednocześnie łagodząc często współistniejące objawy depresyjne [96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112].
W farmakoterapii nadreaktywności pęcherza sięgnięto także po inne
preparaty z powodzeniem stosowane w innych gałęziach medycyny:
blokery kanału wapniowego (np. nifedypina), blokery receptorów
alfa-adrenergicznych (doxazosyna) oraz hormony (estrogeny stosowane doustnie lub dopochwowo) [113, 114, 115, 116, 117, 118, 119].
W różnych fazach badań znajduje się kilkanaście substancji, potencjalnych
leków [120]:
Pomimo wprowadzenia nowych leków, analiza publikowanych badań klinicznych opartych o kwestionariusze pytań i badania urodynamiczne wykazuje, że pomimo leczenia objawy OAB utrzymują się u większości pacjentów, a farmakoterapia, niezależnie od jej rodzaju, pozwala na osiągnięcie jedynie krótko- i średnioterminowej poprawy jakości życia QoL [121, 122]. Coraz szerzej są opisywane w literaturze medycznej i wprowadzane do zastosowań klinicznych nowe metody leczenia wybiórczo nakierowanego na pęcherz moczowy. Ostrzykiwanie ściany pęcherza moczowego (mięśnia wypieracza) neurotoksyną botulinową typu A powoduje okresowe zablokowanie synaps cholinergicznych, zwiotczenie mięśni gładkich wypieracza i z kolei spadek jego nadaktywności. Opisano skuteczność dopęcherzowego podawania kapsaicyny [123, 124, 125].
Leczenie nadreaktywności pęcherza u mężczyzn
z przerostem gruczołu krokowego
Obserwacja trwała 3 miesiące. U pacjentów stosujących terapię złożoną stwierdzono poprawę jakości życia oraz wzrost pojemności pęcherza. Nie stwierdzono spadku objętości zalegającego moczu po mikcji w stosunku do pacjentów leczonych tylko alfa1-blokerami. Wyniki te znalazły potwierdzenie w kolejnym badaniu 879 mężczyzn z przerostem stercza i objawami nadreaktywności pęcherza leczonych za pomocą w/w preparatów (badanie TIMES). U tych pacjentów stwierdzono istotną poprawę parametrów IPSS (International Prostate Symptom Score) [126, 127, 128, 129, 130, 131, 132]. W sytuacji, gdy leczenie farmakologiczne jest nieskuteczne lub pojawiają się powikłania przerostu gruczołu krokowego (nawracające, oporne na leczenie infekcje, kamica, znaczne zaleganie moczu, nieakceptowane przez chorego obniżenie jakości życia), należy wdrożyć leczenie chirurgiczne, którym z reguły jest elektroresekcja przezcewkowa (TURP). W efekcie tego leczenia znikają objawy związane z przeszkodą podpęcherzową. Po zabiegu objawy nadreaktywności pęcherza moczowego utrzymują się nadal u ok. 19% pacjentów i odsetek ten wzrasta aż do 63% w ciągu kolejnych lat [133, 134, 135, 136, 137, 138, 139]. Leczenie przyczynowe nadreaktywności pęcherza moczowego Zgodnie z teorią uszkodzenia neuronalnego w przypadku nadreaktywności może dochodzić do tzw. wyciekania acetylocholiny z zakończeń nerwowych, w czasie gdy włókna cholinergiczne nie są aktywne. Możliwy jest też rozwój nadmiernej impulsacji aferentnej, powodującej na drodze odśrodkowej stymulację wypieracza i powstawanie parcia naglącego. Te dane stwarzają patofizjologiczne podstawy do zastosowania leków antycholinergicznych, a także do opracowywania nowych metod leczenia ukierunkowanych na wpływanie na poszczególne populacje neuronalne (leki działające na kanały jonowe, neurotoksyny).
Leki wpływające na ośrodkowy układ nerwowy Substancje działające na receptory purynergiczne, których obecność została niedawno wykazana w dolnych drogach moczowych, mogą mieć zastosowanie w leczeniu nadreaktywności pęcherza moczowego. Najbardziej obiecujące wydaje się być stosowanie leków działających na receptory purynergiczne u chorych z neurogennym uszkodzeniem dolnych dróg moczowych oraz u pacjentów w podeszłym wieku. W tych grupach chorych stwierdzono bowiem zwiększoną aktywność transmisji purynergicznej. Kanabinoidy, czyli pochodne marihuany, wpływają na receptory kanabinoidowe w ośrodkowym układzie nerwowym. Preparat podjęzykowy, składający się z mieszaniny tetrahydrokanabinolu i kanabidilu, był podawany w randomizowanym badaniu z wykorzystaniem placebo pacjentom z nadreaktywnością wypieracza i stwardnieniem rozsianym. Wykazano, że Sativex co prawda nie zmniejszał liczby epizodów nietrzymania moczu, ale zmniejszał liczbę mikcji zarówno w nocy, jak i w dzień oraz poprawiał parametry jakości życia. Lek nie wpływał też na dobową produkcję moczu [141]. Zupełnie inne podejście do problemu pęcherza nadreaktywnego zostało przedstawione przez grupę naukowców z Bristolu. Wychodząc z założenia, że głównym czynnikiem ograniczającym pacjentów z pęcherzem nadreaktywnym i limitującym ich możliwości zawodowe jest częstomocz dzienny, badacze ci zaproponowali stosowanie desmopresyny w dawce 0,2 mg rano, celem zmniejszenia częstotliwości mikcji w dzień. Okazało się, że lek zmniejszał liczbę mikcji o jedną (w porównaniu z placebo) w ciągu 8 godzin od zażycia, ale za to aż 78% pacjentów leczonych desmopresyną nie miało w ogóle epizodów nietrzymania moczu do 8 godzin po zażyciu leku. Zaobserwowano też znamienną poprawę jakości życia u pacjentów przyjmujących desmopresynę. Objawy uboczne miały na ogół nie wielkie nasilenie i dotyczyły bólów głowy oraz biegunki. U żadnego z pacjentów nie zaobserwowano hiponatremii [142]. Neurotoksyny w leczeniu nadreaktywności pęcherza moczowego Era neurotoksyn w urologii rozpoczęła się od wykazania istnienia tzw. włókien C-reaktywnych, odpowiedzialnych za reorganizację odruchu mikcji po urazie rdzenia kręgowego. To odkrycie dało początek zastosowaniu selektywnej wobec włókien C neurotoksyny - kapsaicyny. Dalsze badania doprowadziły do odkrycia receptora waniloidowego, który ma charakter kanału jonowego. Okazało się, że kapsaicyna, działając za pośrednictwem receptora waniloidowego (VR1), powoduje najpierw pobudzenie aferentnych włókien typu C, co oczywiście nasila parcie naglące oraz wzmaga czucie bólu, a następnie dopiero dochodzi do neurolizy i porażenia czucia [143]. To spowodowało poszukiwania innej neurotoksyny, pozbawionej działania pobudzającego. Resiniferatoksyna, działająca również za pośrednictwem receptora VR1, nie ma pobudzającego działania na komórki nerwowe, wywołuje jedynie ich porażenie. Resiniferatoksyna powoduje ponadto plastyczność neuronalną, polegającą na zmianie fenotypu neuronów. Resiniferatoksyna znalazła zastosowanie w leczeniu neurogennej i nieneurogennej nadreaktywności wypieracza oraz w leczeniu śródmiąższowego zapalenia pęcherza moczowego. Skuteczność resiniferatoksyny wynosi 45-66% w zależności od schorzenia [143]. Kolejną neurotoksyną pochodzenia bakteryjnego, która znalazła szerokie zastosowanie w neurourologii, jest toksyna botulinowa. Toksyna botulinowa (BTX) jest najsilniejszą neurotoksyną występującą w przyrodzie. Jej działanie polega na hamowaniu uwalniania acetylocholiny w obrębie cholinergicznej synapsy nerwowo- mięśniowej. W praktyce urologicznej używana jest toksyna A - (preparaty Dysport i Botox, różniące się dawkami - dawki nie są równoważne, oraz sposobem przygotowania - zamrażanie i liofilizacja). W największym dostępnym obecnie badaniu klinicznym poddano analizie 200 chorych z neurogenną dysfunkcją pęcherza, którym BTX-A podano w formie iniekcji do ściany pęcherza. W kontroli po 3 i 6 miesiącach stwierdzono statystycznie znamienny wzrost pojemności cystometrycznej pęcherza oraz spadek ciśnień śródpęcherzowych. Toksyna botulinowa może być również stosowana w idiopatycznej nadreaktywności pęcherza moczowego (stosuje się wówczas mniejsze dawki, z uwagi na ryzyko porażenia pęcherza moczowego). Wyniki badań randomizowanych, podwójnie ślepych, kontrolowanych przez placebo wykazały 55% skuteczność BTX w całkowitej eliminacji nadreaktywności wypieracza. W przypadku nadreaktywności na tle idiopatycznym skuteczność wynosi 62,5%, w przeszkodzie podpęcherzowej 85%, a w śródmiąższowym zapaleniu pęcherza 69%. Oprócz zablokowania uwalniania acetylocholiny uważa się, że toksyna botulinowa może wpływać na zakończenia czuciowe zlokalizowane w pęcherzu, co stanowiłoby atrakcyjne wyjaśnienie jej działania w przypadku np. nadreaktywności na tle wzmożonej dośrodkowej impulsacji czuciowej [144, 145].
Leczenie chirurgiczne Nadreaktywność pęcherza moczowego to problem socjologiczny i ekonomiczny Zespół nadreaktywnego pęcherza znalazł się w kręgu zainteresowań urologów i ginekologów. Można to wiązać z rozwojem metod diagnostycznych (badań urodynamicznych), postępami neurofizjologii i wyodrębnianiem się nowych dziedzin medycznych (np. uroginekologii). Przyczyną jest także kierowanie się medycyny oraz przemysłu farmaceutycznego na nowe obszary działalności, związane nie tylko z leczeniem chorób zagrażających życiu, lecz także pogarszających jego jakość. Efektem jest opracowanie szeregu nowych leków do terapii dysfunkcji erekcyjnej czy hormonalnej terapii zastępczej u obu płci. Ze względu na dużą liczbę potencjalnych pacjentów OAB stał się istotnym celem dla firm farmaceutycznych. Tylko wydatki na reklamę stosowanych leków antycholinergicznych wynoszą 127 mln dolarów rocznie, a jest o co walczyć, gdyż roczny wzrost wydatków na te preparaty stanowi 11%. Jak wiele innych schorzeń, OAB jest problemem społecznym i ekonomicznym, ponieważ w istotny sposób ogranicza aktywność życiową pacjentów, głównie w krajach wysokorozwiniętych. Koszty obejmują wydatki bezpośrednio związane z leczeniem choroby i powikłań oraz pośrednie, związane z wyłączeniem jednostki ze społeczeństwa i ograniczeniem aktywności zawodowej [146, 147, 148]. W roku 2000 w USA wyniosły 12,02 mld dolarów, z czego14% przypadło na utrzymanie chorych w domach opieki, 9% na leczenie, 6% stanowiły powikłania, a jedynie 1% przypadło na badania diagnostyczne. Pozostały odsetek stanowiły wydatki na codzienną opiekę i utrata produktywności pacjenta, ocenione na 841 mln dolarów rocznie [149]. Łączne obciążenia społeczne różnych form nietrzymania moczu w USA przekraczają 26 mld dolarów. Obliczony koszt powikłań nadreaktywności pęcherza moczowego obejmował leczenie zwiększonej ilości infekcji dróg moczowych (1,3 mld dolarów) oraz dwukrotnego wzrostu liczby urazów kości (386 mln dolarów) [150]. Urazy te są związane z upadkami i stanowią 23% wydatków na leczenie powikłań OAB. Pacjenci z naglącym nietrzymaniem moczu ponoszą dodatkowe koszty podkładek higienicznych, wynoszące ok. 135 dolarów rocznie, środków do pielęgnacji i leczenia skóry oraz wydatki na zwiększoną liczbę wizyt lekarskich i hospitalizacji [151, 152, 153, 154, 155, 156, 157, 158]. Podsumowanie Objawy zespołu pęcherza nadreaktywnego występują z równą częstotliwością wśród obu płci. W istotny sposób wpływają na pogorszenie jakości życia chorych. Dotychczas brak teorii jednoznacznie wyjaśniających etiologię schorzenia. Leczenie obejmujące zmiany stylu życia, terapie behawioralne oraz farmakoterapię jest skuteczne jedynie u części pacjentów. Objawy mają charakter nawrotowy nawet u chorych, u których uzyskano początkowo znaczną poprawę. W odniesieniu do OAB stwierdzenie Bensona "...wolę mówić pacjentom: wierzę, że masz takie objawy, nie wiem, co jest ich przyczyną, ale zrobię wszystko, abyś poczuł się lepiej" nie straciło na aktualności. dr n. med. Stanisław Wroński
komentarze
Hi guys
I have written a tonne of articles on sex toys, bondage and other stuff with which I have some personal experience :D I would like to contribute these articles to your blog as I think that your audience would enjoy reading them and find them useful. I will try to write some articles.
You can access all the articles from my Google drive: https://drive.google.com/drive/folders/1lhtu2cXbHoiorZ_f_eJg9hxZ5qBW-NJr?usp=sharing
Here are some images and banners that you can use: https://drive.google.com/drive/folders/1gWxexdmp9wIecSU2zrjL7uIYhOUmMg_4?usp=sharing
That is all for now. I will send you some more articles once I get a bit more free time as it is quite busy at work at the moment. I am really trying to expand my blogging presence so it would be awesome if you could link to Anastasia from Peaches and Screams (https://peachesandscreams.co.uk). I am a full time blogger with them.
I am also attaching my picture that you could use with each article :) You can select any of my bio pics from this folder: https://drive.google.com/drive/folders/19G0Na36YxaAgki6aR5pL0fpcTvbddhSM?usp=sharing
Cheers
Anastasia x
Hi, it's Ouida!
Almost everyone is using voice search with their Siri/Google/Alexa to ask for services and products now, and in 2019, it'll be EVERYONE of your potential clients. Imagine what you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's BAD), competitors above are getting all the traffic and business!
Answer all your visitors' questions on your website and win their business! Find out how easy it is here: https://goo.gl/6h8hfW
Get your VSO voice search optimized content: https://goo.gl/tQh8J7
Best,
Ouida
Hi, it's Dwight!
Almost everyone is using voice search with their Siri/Google/Alexa to ask for services and products now, and in 2019, it'll be EVERYONE of your potential clients. What you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), competitors above are getting all the traffic and $$$$!
Answer all your visitors' questions on your website and win their trust! Learn how simple it is here: https://goo.gl/6h8hfW
Get your voice search optimized content: https://goo.gl/tQh8J7
Best,
Dwight
Hey, it's Vada!
Pretty much everyone is using voice search with their Siri/Google/Alexa to ask for services and products now, and in 2019, it'll be EVERYONE of your potential clients. What you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), businesses above are winning all the traffic and business!
Fulfill all your buyers' questions on your site and earn their business! Find out how easy it is here: https://goo.gl/6h8hfW
Get your voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Regards,
Vada
Hey, it's Enrique!
Pretty much everyone is using voice search with their Siri/Google/Alexa to ask for services and products in 2018, and next year, it'll be EVERYONE of your clients. What you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), businesses on top are getting all the traffic and $$$$!
Answer all your buyers' questions on your site and earn their business! Find out how easy it is here: https://goo.gl/6h8hfW
Get your voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Cheers,
Enrique
Hey, it's Dustin!
Almost everyone is using voice search with their Siri/Google/Alexa to ask for services and products in 2018, and next year, it'll be EVERYONE of your potential customers. What you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), businesses on top are getting all the traffic and $$$$!
Answer all your buyers' questions on your site and earn their trust! Find out how simple it is here: https://goo.gl/6h8hfW
Get your voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Best,
Dustin
Buy Marijuana this christmas safely and securely online
24 hours delivery with secure packaging(we ship worldwide)
Buy CBD and THC marijuana legally from home!
Are you feeling depressed or stressed?Do you suffer from insomnia? MEDICAL CANNABIS can help you! You dont have to look for a dealer and take any risks.Order Cannabis securely and privately from home!
Buy now at https://herbalmarijuanastore.com/
Hey, it's Reyes!
Pretty much everyone is using voice search with their Siri/Google/Alexa to ask for services and products now, and in 2019, it'll be EVERYONE of your customers. Imagine what you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), businesses on top are earning all the traffic and business!
Answer all your buyers' questions on your site and win their business! Learn how simple it is here: https://goo.gl/6h8hfW
Get your VSO voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Best,
Reyes
Hi, it's Ernestina!
Almost everyone is using voice search with their Siri/Google/Alexa to ask for services and products now, and in 2019, it'll be EVERYONE of your potential clients. What you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), businesses above are winning all the traffic and $$$$!
Answer all your clients' questions on your site and earn their trust! Find out how simple it is : https://goo.gl/6h8hfW
Get your voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Best,
Ernestina
Hey, it's Norberto!
Pretty much everyone is using voice search with their Siri/Google/Alexa to ask for services and products in 2018, and in 2019, it'll be EVERYONE of your potential customers. What you are missing out on.
Right now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's NOT good), businesses above are earning all the traffic and business!
Fulfill all your visitors' questions on your site and earn their trust! Learn how easy it is : https://goo.gl/6h8hfW
Get your VSO voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Regards,
Norberto
Hi, it's Stephany!
Pretty much everyone is using voice search with their Siri/Google/Alexa to ask for services and products now, and next year, it'll be EVERYONE of your potential clients. What you are missing out on.
Just now, I can only find przeglad-urologiczny.pl on text search after digging a few pages (that's BAD), competitors above are getting all the traffic and business!
Fulfill all your buyers' questions on your website and win their trust! Find out how easy it is : https://goo.gl/6h8hfW
Get your VSO voice search optimized content: https://goo.gl/tQh8J7
Starts at $20, regular SEO content starts at $10
Regards,
Stephany
Hi
I wanted to order a item from your webshop.
but I can not find the product anymore on your site,
it looks like this on this site https://bit.ly/ProductItem735
I hope you will sell the product again soon,
mail me if you are going to sell it again, I'll wait
Greetings
Hello,
How are you dear?
I am just contacting to you because you are in the field of digital marketing.
You may know or need Ahrefs tool?
We provide it at just $10/month: https://buyseotools.org
If you have any question just contact us;
Email: buyseotools.org@gmail.com
Skype: live:buyseotools.org
Regards,
BuySEOTools Team
https://www.buyseotools.org
Hello there,
My name is Aly and I would like to know if you would have any interest to have your website here at przeglad-urologiczny.pl promoted as a resource on our blog alychidesign.com ?
We are in the midst of updating our broken link resources to include current and up to date resources for our readers. Our resource links are manually approved allowing us to mark a link as a do-follow link as well
.
If you may be interested please in being included as a resource on our blog, please let me know.
Thanks,
Aly
Hi again
I have tried sending you a message on your site but I got an email saying it was not delivered so here goes again. It would be great if you could let me know if you have received my email and article.
I would like to contribute an article to your blog on how cryptocurrencies are reshaping the cannabis and CBD industry. I have used a couple of CBD sites in the UK to buy CBD oil using cryptocurrency. I realised just how much of an impact cryptocurrencies will have on the cannabis industry (which is heavily regulated) and I therefore decided to write this article. Hopefully, your readers will find it useful.
I have saved the article in a word document on my G-Drive which you can access from here:
https://drive.google.com/drive/folders/1KDnahFgKRGeio0gPiJ61GcftlAyhZvZT?usp=sharing
I am very sorry but I did not have the time to collect some images so please feel free to add some of your own.
If you like my article, I can write a couple more once I get some free time (it is crazy busy at work right now after the new year).
Have an awesome day!
Regards
Tony
Hello there,
My name is Aly and I would like to know if you would have any interest to have your website here at przeglad-urologiczny.pl promoted as a resource on our blog alychidesign.com ?
We are in the midst of updating our broken link resources to include current and up to date resources for our readers. Our resource links are manually approved allowing us to mark a link as a do-follow link as well
.
If you may be interested please in being included as a resource on our blog, please let me know.
Thanks,
Aly
Hello there,
My name is Aly and I would like to know if you would have any interest to have your website here at przeglad-urologiczny.pl promoted as a resource on our blog alychidesign.com ?
We are in the midst of updating our broken link resources to include current and up to date resources for our readers. Our resource links are manually approved allowing us to mark a link as a do-follow link as well
.
If you may be interested please in being included as a resource on our blog, please let me know.
Thanks,
Aly
Hello,
How are you dear?
I am just contacting to you because you are in the field of digital marketing.
You may know or need Ahrefs tool?
We provide it at just $10/month: https://buyseotools.org
If you have any question just contact us;
Email: buyseotools.org@gmail.com
Skype: live:buyseotools.org
Regards,
BuySEOTools Team
https://www.buyseotools.org
I have access to a massive network of around 10,000 CBD and Hemp related blogs. I have been using these blogs to rank vape shops and CBD sites on top of the search engines.
With this gig, you will receive a guest post on each blog (I will create unique content).
These links is literally all that you need to rank at the top of the search engines as far as link building goes.
Here are the key features of the links:
Insanely strong domain metrics: domain authority from 50 to 80!!!
Do Follow and contextual links
100% permanent and indexable with the search engines
100% CBD and hemp niche related.
To get started, please send me your website and up to 50 keywords you would like to rank for (one key word per line).
https://www.fiverr.com/alecmonopoly/create-backlinks-on-hemp-and-cbd-blogs
Hi again
I have tried sending you a message on your site but I got an email saying it was not delivered so here goes again. It would be great if you could let me know if you have received my email and article.
I would like to contribute an article to your blog on how cryptocurrencies are reshaping the cannabis and CBD industry. I have used a couple of CBD sites in the UK to buy CBD oil using cryptocurrency. I realised just how much of an impact cryptocurrencies will have on the cannabis industry (which is heavily regulated) and I therefore decided to write this article. Hopefully, your readers will find it useful.
I have saved the article in a word document on my G-Drive which you can access from here:
https://drive.google.com/drive/folders/1KDnahFgKRGeio0gPiJ61GcftlAyhZvZT?usp=sharing
I am very sorry but I did not have the time to collect some images so please feel free to add some of your own.
If you like my article, I can write a couple more once I get some free time (it is crazy busy at work right now after the new year).
Have an awesome day!
Regards
Tony
Hi again
I have tried sending you a message on your site but I got an email saying it was not delivered so here goes again. It would be great if you could let me know if you have received my email and article.
I would like to contribute an article to your blog on how cryptocurrencies are reshaping the cannabis and CBD industry. I have used a couple of CBD sites in the UK to buy CBD oil using cryptocurrency. I realised just how much of an impact cryptocurrencies will have on the cannabis industry (which is heavily regulated) and I therefore decided to write this article. Hopefully, your readers will find it useful.
I have saved the article in a word document on my G-Drive which you can access from here:
https://drive.google.com/drive/folders/1KDnahFgKRGeio0gPiJ61GcftlAyhZvZT?usp=sharing
I am very sorry but I did not have the time to collect some images so please feel free to add some of your own.
If you like my article, I can write a couple more once I get some free time (it is crazy busy at work right now after the new year).
Have an awesome day!
Regards
Tony
Hi again
I have tried sending you a message on your site but I got an email saying it was not delivered so here goes again. It would be great if you could let me know if you have received my email and article.
I would like to contribute an article to your blog on how cryptocurrencies are reshaping the cannabis and CBD industry. I have used a couple of CBD sites in the UK to buy CBD oil using cryptocurrency. I realised just how much of an impact cryptocurrencies will have on the cannabis industry (which is heavily regulated) and I therefore decided to write this article. Hopefully, your readers will find it useful.
I have saved the article in a word document on my G-Drive which you can access from here:
https://drive.google.com/drive/folders/1KDnahFgKRGeio0gPiJ61GcftlAyhZvZT?usp=sharing
I am very sorry but I did not have the time to collect some images so please feel free to add some of your own.
If you like my article, I can write a couple more once I get some free time (it is crazy busy at work right now after the new year).
Have an awesome day!
Regards
Tony
Hello
I have written a couple of articles on CBD from multiple angles and would love to contribute these articles to your blog.
I have saved the articles on my Google drive which you can access from here: https://drive.google.com/drive/folders/1y96hoCPHfKWh52MtfDoRRdjaeBQR37rq?usp=sharing
I am sorry but I did not have any time to find some good images so it would be fab if you could add some.
Keep up the great work on your site!
Regards
I am currently working with some of the biggest vape wholesalers, MOD makers, e-juice brands and vape shops. I am sure that you have heard of them all or seen them at most vape expos. To put it bluntly, I know what works and what doesn't. I now know the vape industry like the back of my hand.
I have taken all the most effective elements of my vape seo equation and lumped them into these incredibly cheap packages, which I would sell for about 10 times the amount I am selling them for here.
I have divided the packages on the basis of the amount of competition you are facing. So here is the breakdown of what exactly you will get with each package:
Mouse (ideal for small local vape shops located in the suburbs):
100 links inside my vape and ejuice blogs
50 bookmarks and social signals
Indexing
Cat (mid-sized vape companies)
500 backlinks inside vape blogs
250 social bookmarks
promotion on 5,000 forums
Around 10,000 mixed blog comment, PBN and other links to increase your domain authority
Bear (ideal for companies based in large cities)
1500 vapor blog links
500 social bookmarks
Promotion on 10,000 forums
20,000 mixed links
Indexing
Guest Posts on 5 strong sites
Lots of Extras
To learn more, please visit https://www.fiverr.com/ghosttownseo/create-a-full-vape-backlinks-package
Hi again
I have tried sending you a message on your site but I got an email saying it was not delivered so here goes again. It would be great if you could let me know if you have received my email and article.
I would like to contribute an article to your blog on how cryptocurrencies are reshaping the cannabis and CBD industry. I have used a couple of CBD sites in the UK to buy CBD oil using cryptocurrency. I realised just how much of an impact cryptocurrencies will have on the cannabis industry (which is heavily regulated) and I therefore decided to write this article. Hopefully, your readers will find it useful.
I have saved the article in a word document on my G-Drive which you can access from here:
https://drive.google.com/drive/folders/1KDnahFgKRGeio0gPiJ61GcftlAyhZvZT?usp=sharing
I am very sorry but I did not have the time to collect some images so please feel free to add some of your own.
If you like my article, I can write a couple more once I get some free time (it is crazy busy at work right now after the new year).
Have an awesome day!
Regards
Tony
Hello
I have written a couple of articles on CBD from multiple angles and would love to contribute these articles to your blog.
I have saved the articles on my Google drive which you can access from here: https://drive.google.com/drive/folders/1y96hoCPHfKWh52MtfDoRRdjaeBQR37rq?usp=sharing
I am sorry but I did not have any time to find some good images so it would be fab if you could add some.
Keep up the great work on your site!
Regards
Hi again
I have tried sending you a message on your site but I got an email saying it was not delivered so here goes again. It would be great if you could let me know if you have received my email and article.
I would like to contribute an article to your blog on how cryptocurrencies are reshaping the cannabis and CBD industry. I have used a couple of CBD sites in the UK to buy CBD oil using cryptocurrency. I realised just how much of an impact cryptocurrencies will have on the cannabis industry (which is heavily regulated) and I therefore decided to write this article. Hopefully, your readers will find it useful.
I have saved the article in a word document on my G-Drive which you can access from here:
https://drive.google.com/drive/folders/1KDnahFgKRGeio0gPiJ61GcftlAyhZvZT?usp=sharing
I am very sorry but I did not have the time to collect some images so please feel free to add some of your own.
If you like my article, I can write a couple more once I get some free time (it is crazy busy at work right now after the new year).
Have an awesome day!
Regards
Tony
GLOBAL VAPE SHOP DATABASE AND VAPE STORE EMAIL LIST
Do you run an e-liquid company or a vape wholesale or distribution business? Are you tired of hitting the wall with your marketing efforts? Would you like to start exploding your sales with a click of a button? Let us now share with you the secret sauce that has powered some of the biggest e-juice brands from around the world: The Global Vape Shop Email List!
Global Vape Shop Database and Vape Store Email List - https://bit.ly/2V3ZKAU
WHAT IS THE GLOBAL VAPE SHOP EMAIL LIST AND WHAT DOES IT CONTAIN
The Global Vape Shop Email List is an Excel spreadsheet containing vape shop contact details. The spreadsheet comes with many tabs for different countries and each tab contains the vape shop contact details for that respective country.
The Global Vape Shop Database contains vape shop names, emails, websites, telephone numbers, locations and store addresses, social media links and much more! Our database has around 15,000 vape shops but this number is approximate because the vape shop numbers fluctuate following updates.
Click here to learn more and purchase the database: https://bit.ly/2V3ZKAU
GLOBAL VAPE COMPANY EMAIL LIST OF VAPE SHOPS AND VAPE WHOLESALERS AND E-LIQUID DISTRIBUTORS
Global Vape Company Email List of Vape Shops and Vape Wholesalers and E-Liquid Distributors
Did you know that there are over 38,000 vape companies around the world that you can contact today? Whether you run an e-liquid line or a vape wholesale business, these vape company emails can help you to reach practically all vape companies with your message. Are you tired from not making enough B2B sales to vape shops and vape wholesalers? Do you find most of your marketing to be unproductive? Do you want to take your vape business to the next level and start exploding your sales? Here is the secret sauce that has helped over 500 e-liquid brands and wholesalers from around the world since 2012! Some ejuice companies have even tried to buy us out because they felt that the accessibility of this list was putting them against a lot of competition from smaller vape companies and e-liquid brands! This hopefully helps to illustrate just how powerful this vape company email list is!
HERE IS WHAT THE VAPE COMPANY EMAIL LIST CONTAINS:
Vape Shops (brick-and-mortar and online)
Vape Wholesalers and distributors
E-Liquid Companies
Vape Event Organisers
Vape magazines
Vape reviewers
HERE ARE THE WAYS IN WHICH YOU CAN USE THIS VAPE COMPANY EMAIL LIST
Promotional messages
Introductory emails
Guest post outreach for backlink building
Much more
Buy and learn more at https://bit.ly/2zcDKeX
GLOBAL VAPE COMPANY EMAIL LIST OF VAPE SHOPS AND VAPE WHOLESALERS AND E-LIQUID DISTRIBUTORS
Global Vape Company Email List of Vape Shops and Vape Wholesalers and E-Liquid Distributors
Did you know that there are over 38,000 vape companies around the world that you can contact today? Whether you run an e-liquid line or a vape wholesale business, these vape company emails can help you to reach practically all vape companies with your message. Are you tired from not making enough B2B sales to vape shops and vape wholesalers? Do you find most of your marketing to be unproductive? Do you want to take your vape business to the next level and start exploding your sales? Here is the secret sauce that has helped over 500 e-liquid brands and wholesalers from around the world since 2012! Some ejuice companies have even tried to buy us out because they felt that the accessibility of this list was putting them against a lot of competition from smaller vape companies and e-liquid brands! This hopefully helps to illustrate just how powerful this vape company email list is!
HERE IS WHAT THE VAPE COMPANY EMAIL LIST CONTAINS:
Vape Shops (brick-and-mortar and online)
Vape Wholesalers and distributors
E-Liquid Companies
Vape Event Organisers
Vape magazines
Vape reviewers
HERE ARE THE WAYS IN WHICH YOU CAN USE THIS VAPE COMPANY EMAIL LIST
Promotional messages
Introductory emails
Guest post outreach for backlink building
Much more
Buy and learn more at https://bit.ly/2zcDKeX
Good morning
I am looking to build up my B2B email list for newsletter marketing.
I am very keen to get Ivy's B2B Leads Miner - Yellow Pages Scraper Software as it is probably one of the best Yellow Pages scrapers for UK and USA out there.
I was just wondering if you have ever used this particular or any other scrapers before?
Cheers guys!
WHY E-MAIL MARKETING IS CRUCIAL FOR YOUR VAPE BUSINESS?
Having operated in the vape industry for over 8 years, we can confidently say that e-mail marketing gets the results. E-mail marketing such as plain introductory e-mails and newsletters help your vape business to get your message across to thousands of vape shops, e-liquid wholesalers and other types of vape businesses. However, in order to make an impact with your newsletter campaign, you have to have quality, verified and cleaned mailing list of vape businesses.
A DEFINITIVE AND MOST COMPREHENSIVE E-MAIL LIST OF ALL VAPE SHOPS, E-LIQUID BRANDS, E-LIQUID WHOLESALERS, VAPE DISTRIBUTORS, VAPE EVENT ORGANISERS, ONLINE VAPE SHOPS, BRICK-AND-MORTAR VAPE SHOPS, VAPE MAGAZINES AND VAPE COMMUNITIES IS FINALLY HERE!
Following multiple requests from our clients, our e-mail marketing team has worked hard over the past three months to bring you an e-mail list of ALL vape businesses around the world. We have combined all e-mail addresses from our vape shop databases, contacts, business cards from over 50 vape exhibitions, public domain, subscriber lists and other sources. Our entire mailing list has been scrubbed to weed out vape businesses that have gone out of business or changed their domain names to bring you a clean and verified mailing list of vape businesses around the world. Upon payment, the Vape Company E-Mail Mailing List is available as an INSTANT DOWNLOAD in a notepad .txt format that you can simply upload to your subscriber list. Then all you have to do is create a beautiful newsletter campaign and hit the send button. Our Vape Company E-Mail Mailing List has over 38,000 email addresses of brick-and-mortar vape shops, e-liquid wholesalers and distributors, online vape shops, e-liquid brands, vape event organisers, vape communities, vape magazines, vape reviewers and much more! Our team is constantly verifying and updating the Vape Company email list to bring you only the latest vape company leads.
DOWNLOAD A SAMPLE OF OUR GLOBAL E-MAIL LIST OF ALL VAPE COMPANIES IN THE WORLD
https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
Hello there,
My name is Aly and I would like to know if you would have any interest to have your website here at przeglad-urologiczny.pl promoted as a resource on our blog alychidesign.com ?
We are in the midst of updating our broken link resources to include current and up to date resources for our readers. Our resource links are manually approved allowing us to mark a link as a do-follow link as well
.
If you may be interested please in being included as a resource on our blog, please let me know.
Thanks,
Aly
I am currently working with some of the biggest vape wholesalers, MOD makers, e-juice brands and vape shops. I am sure that you have heard of them all or seen them at most vape expos. To put it bluntly, I know what works and what doesn't. I now know the vape industry like the back of my hand.
I have taken all the most effective elements of my vape seo equation and lumped them into these incredibly cheap packages, which I would sell for about 10 times the amount I am selling them for here.
I have divided the packages on the basis of the amount of competition you are facing. So here is the breakdown of what exactly you will get with each package:
Mouse (ideal for small local vape shops located in the suburbs):
100 links inside my vape and ejuice blogs
50 bookmarks and social signals
Indexing
Cat (mid-sized vape companies)
500 backlinks inside vape blogs
250 social bookmarks
promotion on 5,000 forums
Around 10,000 mixed blog comment, PBN and other links to increase your domain authority
Bear (ideal for companies based in large cities)
1500 vapor blog links
500 social bookmarks
Promotion on 10,000 forums
20,000 mixed links
Indexing
Guest Posts on 5 strong sites
Lots of Extras
To learn more, please visit https://www.fiverr.com/ghosttownseo/create-a-full-vape-backlinks-package
WHAT IS A VAPE PBN BACKLINK, AND HOW CAN IT HELP YOU MARKET YOUR E-CIGARETTE BUSINESS ONLINE?
Backlinks are similar to citations found in non-fiction books. They are references to your website, made by other websites that drive traffic to your online content. The more substantive and qualitative backlinks a website has the better search results your site will receive. However, finding reputable backlinks from e-cigarette sites can be very difficult. Without qualitative references by well-respected websites your online business will suffer. Our E-Cigarette Backlink Package contains substantive, reputable backlinks that can help you improve your websites search-ability.
MUST WATCH: COMPLETE GUIDE TO VAPE SEO, VAPE MARKETING & VAPE BACKLINKS
https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-for-shops-seo
WORLD'S #1 UK VAPE SHOP DATABASE
Do you own an e-liquid or a vape brand? Are you looking to sell your product to vape shops directly? Our UK vape store database is the best and most important investment you will make for your vape business. There is simply no point of having a beautiful website and a great brand if nobody has heard of it or will never see it. Our vape shop database will help to connect your brand with vape stores which will equal to brand exposure, higher sales and greater profit. Just over 500 e-liquid and mod brands have purchased our database and have made significant gains. Some of these brands are already so large that you will have heard of them! Our database of UK vape shops will help you to expand your target audience. There are many ways in which you can use the UK vape shop database including vape email marketing campaigns, newsletters, telemarketing, sending of e-liquid samples, vape shop visits and much more!
https://theeliquidboutique.co.uk/products/uk-vape-shop-database
WORLD'S #1 UK VAPE SHOP DATABASE
Do you own an e-liquid or a vape brand? Are you looking to sell your product to vape shops directly? Our UK vape store database is the best and most important investment you will make for your vape business. There is simply no point of having a beautiful website and a great brand if nobody has heard of it or will never see it. Our vape shop database will help to connect your brand with vape stores which will equal to brand exposure, higher sales and greater profit. Just over 500 e-liquid and mod brands have purchased our database and have made significant gains. Some of these brands are already so large that you will have heard of them! Our database of UK vape shops will help you to expand your target audience. There are many ways in which you can use the UK vape shop database including vape email marketing campaigns, newsletters, telemarketing, sending of e-liquid samples, vape shop visits and much more!
https://theeliquidboutique.co.uk/products/uk-vape-shop-database
Content marketing is extremely important for increasing your website traffic as well as your SEO rankings. Right now, the major search engines are looking at how long visitors are spending on your site to decide how to rank your site.
It is extremely important to have QUALITY blog posts that are interesting to read and add value to your site. As my experience has shown, poor quality spun articles will get you nowhere.
I have been involved in the vape market for the past 7 years and know pretty much everything about it, including all the major vape companies, e-juice brands, vape mods, nicotine salts, vape laws and more.
With this service, I will write up articles for your blog. I recommend that you keep your article titles relatively broad instead of focusing too much on individual products. Each piece will be conversational, well-researched and fun to read.
Simply send me your article titles and leave everything else to me.
Frequently Asked Questions
I need more than 10 articles.
You can order multiple packages or I could send you a custom offer, whichever works best for you.
What makes you a good writer?
My knowledge of the vape industry is what gives me an unparalleled advantage over other writers who have no experience in this field. Instead of writing the bare basics about the vape market, I can also write very critical and in-depth pieces.
Can you help me to come up with the topics?
Absolutely. Just send me your site and tell me a bit more about your business and I will put together some prospective titles.
How do I choose my blog titles?
I would recommend that you do not choose very broad article titles such as what is vaping because it will be very difficult to rank this article on the search engines due to the high keyword competition. Try to stick to more specialised titles such as nicotine salts guide.
Why is content important for my blog?
Each piece of content or each article translates into more visitors. More quality content equals to more visitors.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5405-i-will-write-10-quality-vape-articles-for-your-blog
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
Content marketing is extremely important for increasing your website traffic as well as your SEO rankings. Right now, the major search engines are looking at how long visitors are spending on your site to decide how to rank your site.
It is extremely important to have QUALITY blog posts that are interesting to read and add value to your site. As my experience has shown, poor quality spun articles will get you nowhere.
I have been involved in the vape market for the past 7 years and know pretty much everything about it, including all the major vape companies, e-juice brands, vape mods, nicotine salts, vape laws and more.
With this service, I will write up articles for your blog. I recommend that you keep your article titles relatively broad instead of focusing too much on individual products. Each piece will be conversational, well-researched and fun to read.
Simply send me your article titles and leave everything else to me.
Frequently Asked Questions
I need more than 10 articles.
You can order multiple packages or I could send you a custom offer, whichever works best for you.
What makes you a good writer?
My knowledge of the vape industry is what gives me an unparalleled advantage over other writers who have no experience in this field. Instead of writing the bare basics about the vape market, I can also write very critical and in-depth pieces.
Can you help me to come up with the topics?
Absolutely. Just send me your site and tell me a bit more about your business and I will put together some prospective titles.
How do I choose my blog titles?
I would recommend that you do not choose very broad article titles such as what is vaping because it will be very difficult to rank this article on the search engines due to the high keyword competition. Try to stick to more specialised titles such as nicotine salts guide.
Why is content important for my blog?
Each piece of content or each article translates into more visitors. More quality content equals to more visitors.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5405-i-will-write-10-quality-vape-articles-for-your-blog
Download your vape company emails
The latest version of the vape company and vape store email list has been released.
If you are already subscribed to the service, you should have received your download link.
To view the latest changelog, please head over to https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
GLOBAL VAPE COMPANY EMAIL LIST OF VAPE SHOPS AND VAPE WHOLESALERS AND E-LIQUID DISTRIBUTORS
Global Vape Company Email List of Vape Shops and Vape Wholesalers and E-Liquid Distributors
Did you know that there are over 38,000 vape companies around the world that you can contact today? Whether you run an e-liquid line or a vape wholesale business, these vape company emails can help you to reach practically all vape companies with your message. Are you tired from not making enough B2B sales to vape shops and vape wholesalers? Do you find most of your marketing to be unproductive? Do you want to take your vape business to the next level and start exploding your sales? Here is the secret sauce that has helped over 500 e-liquid brands and wholesalers from around the world since 2012! Some ejuice companies have even tried to buy us out because they felt that the accessibility of this list was putting them against a lot of competition from smaller vape companies and e-liquid brands! This hopefully helps to illustrate just how powerful this vape company email list is!
HERE IS WHAT THE VAPE COMPANY EMAIL LIST CONTAINS:
Vape Shops (brick-and-mortar and online)
Vape Wholesalers and distributors
E-Liquid Companies
Vape Event Organisers
Vape magazines
Vape reviewers
HERE ARE THE WAYS IN WHICH YOU CAN USE THIS VAPE COMPANY EMAIL LIST
Promotional messages
Introductory emails
Guest post outreach for backlink building
Much more
Buy and learn more at https://bit.ly/2zcDKeX
I will create backlinks on my e-liquid and vape blogs built on very high authority domains. Choose the package that most suits your budget and competition you are facing. All extras are highly recommended.
These vape backlinks will help to increase your vape shop's domain authority and search engine rankings as well as your sales.
Simply send me the keywords you would like to rank for and I will create individual blog posts on each vape blog and add a link to your site with your preferred anchor text. I will embed some vape-related images and video reviews.
All work is done manually using content related to your keywords.
All of my blogs are hosted on different servers and have different IP addresses.
Order now at https://bit.ly/2Vd2FqX
The vape industry has grown exponentially since 2012. It all started off with the ego starter kits, then progressed to dripping and subohming and now we seem to have reached the heights of nicotine salts, shortfill e-liquids, CBD and Juul devices. Thousands of brick-and-mortar vape shops have opened all around the world. New online vape shop start-ups are emerging on a daily basis. The competition in the vape industry has become cut throat! Back in 2012, it was a breeze to rank for competitive vape keywords on most search engines whilst today, it is even becoming difficult to rank for local area post codes as every corner of every city seems to have a growing vape shop demographic.
We were the first vape SEO company in the world and we know the vape industry inside out. We have ranked some of the biggest e-juice brands since when they were starting out, vape shops that were to become some of the biggest chains in the country, vape wholesalers, event organisers and many other different types of vape sites. Our deep knowledge of the SEO and the vape industries allows us to understand the unique business models of our clients and exactly what it takes to rank a vape shop to the very top of the search engines.
WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE
As we have mentioned above, since working with many vape businesses, we have created a blueprint for ranking a site. We have gone through numerous trial and errors and know what works and what does not work. In the current SEO climate, major search engines are putting a greater emphasis on the overall domain authority and metrics of a site as well as brand and onsite visitor behaviour (browsing, click-throughs and bounces). We are constantly adjusting our package to ensure that all of our practices are closely attuned to the latest SEO best-practices and search engine algorithms.
HERE IS WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE AND WHY IT IS IMPORTANT FOR YOUR SITE:
1,000 backlinks on vape and e-liquid blogs: all of the links are do follow, permanent and 100% related to the vaping niche. This helps the search engines to classify your site and rank it higher on the basis of the fact that it has a lot of links coming from designated vape blogs. Moreover, each vape blog has a very high domain authority which will pass on a lot of link equity to you site.
5,000+ forum posts: we will post out a unique message about your website or brand on the most popular forums in the world. Not only will this help to generate awareness about your brand but will also give you a lot of backlinks and direct visitors to your site.
Guest posts on very powerful sites: we have exclusive access to some very popular and powerful sites on which we can place guests posts with links to your site.
Mixed backlinks: in addition to the above work, we will also create some mixed backlinks for some diversity. This would include some blog comments, video comments and more.
Indexing: we will index your links with the major searhc engines at a very natural and steady pace to keep the search engine red flags at bay!
Learn more and buy at
https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
Hi!
I wanted to ask you if you have heard of this vape seo package (https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-for-shops-seo)?
I was told that many leading companies in the industry are using it with the likes of vapor dna, vape ranger, element eliquids, ie vapor, ejuices.co, marina vape and other big players.
I just wanted to check whether you have used them before as I can see that you have a backlink from https://wowitloveithaveit.com so my natural assumption is that you are working with these guys.
Would you recommend them?
Cheers
Are you looking to make your e-liquid or vape brand a global success? Do you want to see your e-liquid or vape brand inside every shop around the world? Our global vape shop database will connect your vape brand with thousands of vape shops around the world and subsequently, increase your revenues and profit. Our global vape shop database has been compiled manually by our internal team over a long period of time through contacts gained at vape exhibitions and publicly available resources.
Do you ever wonder, how today's big e-juice brands became big? They did what mattered the most- approached vape stores and established a rapport with vape store owners. We see many excellent e-juice brands that still fail or do not do as well as they should, simply because they do not do what matters- SELL THEIR E-JUICE TO VAPE SHOPS! (this should be the ultimate goal of any vape-related business). Our Global Vape Shop Database connects the dots between e-juice brands and the vape shops!
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://theeliquidboutique.co.uk/products/global-vape-shop-database
WORLD'S #1 UK VAPE SHOP DATABASE
Do you own an e-liquid or a vape brand? Are you looking to sell your product to vape shops directly? Our UK vape store database is the best and most important investment you will make for your vape business. There is simply no point of having a beautiful website and a great brand if nobody has heard of it or will never see it. Our vape shop database will help to connect your brand with vape stores which will equal to brand exposure, higher sales and greater profit. Just over 500 e-liquid and mod brands have purchased our database and have made significant gains. Some of these brands are already so large that you will have heard of them! Our database of UK vape shops will help you to expand your target audience. There are many ways in which you can use the UK vape shop database including vape email marketing campaigns, newsletters, telemarketing, sending of e-liquid samples, vape shop visits and much more!
https://theeliquidboutique.co.uk/products/uk-vape-shop-database
Good morning
I am looking to build up my B2B email list for newsletter marketing.
I am very keen to get Ivy's B2B Leads Miner - Yellow Pages Scraper Software as it is probably one of the best Yellow Pages scrapers for UK and USA out there.
I was just wondering if you have ever used this particular or any other scrapers before?
Cheers guys!
Hi
I have noticed that your site has a few links from some quality CBD blogs.
Are you by any means using this CBD SEO backlinks package? https://wowitloveithaveit.com/products/hemp-and-cbd-seo-backlinks-package
I am starting out with my CBD gummies site and need to invest in SEO to rank well on Google but I thought I would check in with you first.
I really appreciate your help.
Regards
A DEFINITIVE AND MOST COMPREHENSIVE E-MAIL LIST OF ALL VAPE SHOPS, E-LIQUID BRANDS, E-LIQUID WHOLESALERS, VAPE DISTRIBUTORS, VAPE EVENT ORGANISERS, ONLINE VAPE SHOPS, BRICK-AND-MORTAR VAPE SHOPS, VAPE MAGAZINES AND VAPE COMMUNITIES IS FINALLY HERE!
Following multiple requests from our clients, our e-mail marketing team has worked hard over the past three months to bring you an e-mail list of ALL vape businesses around the world. We have combined all e-mail addresses from our vape shop databases, contacts, business cards from over 50 vape exhibitions, public domain, subscriber lists and other sources. Our entire mailing list has been scrubbed to weed out vape businesses that have gone out of business or changed their domain names to bring you a clean and verified mailing list of vape businesses around the world. Upon payment, the Vape Company E-Mail Mailing List is available as an INSTANT DOWNLOAD in a notepad .txt format that you can simply upload to your subscriber list. Then all you have to do is create a beautiful newsletter campaign and hit the send button. Our Vape Company E-Mail Mailing List has over 38,000 email addresses of brick-and-mortar vape shops, e-liquid wholesalers and distributors, online vape shops, e-liquid brands, vape event organisers, vape communities, vape magazines, vape reviewers and much more! Our team is constantly verifying and updating the Vape Company email list to bring you only the latest vape company leads.
DOWNLOAD A SAMPLE OF OUR GLOBAL E-MAIL LIST OF ALL VAPE COMPANIES IN THE WORLD
https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
Hi guys
I was spoken to someone from your team some time ago about vape marketing.
As promised, I am sending you the link to the digital marketing company that helped to rank my online vape shop: https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
I hope this helps!
Have a fab day and see you very soon :)
Content marketing is extremely important for increasing your website traffic as well as your SEO rankings. Right now, the major search engines are looking at how long visitors are spending on your site to decide how to rank your site.
It is extremely important to have QUALITY blog posts that are interesting to read and add value to your site. As my experience has shown, poor quality spun articles will get you nowhere.
I have been involved in the vape market for the past 7 years and know pretty much everything about it, including all the major vape companies, e-juice brands, vape mods, nicotine salts, vape laws and more.
With this service, I will write up articles for your blog. I recommend that you keep your article titles relatively broad instead of focusing too much on individual products. Each piece will be conversational, well-researched and fun to read.
Simply send me your article titles and leave everything else to me.
Frequently Asked Questions
I need more than 10 articles.
You can order multiple packages or I could send you a custom offer, whichever works best for you.
What makes you a good writer?
My knowledge of the vape industry is what gives me an unparalleled advantage over other writers who have no experience in this field. Instead of writing the bare basics about the vape market, I can also write very critical and in-depth pieces.
Can you help me to come up with the topics?
Absolutely. Just send me your site and tell me a bit more about your business and I will put together some prospective titles.
How do I choose my blog titles?
I would recommend that you do not choose very broad article titles such as what is vaping because it will be very difficult to rank this article on the search engines due to the high keyword competition. Try to stick to more specialised titles such as nicotine salts guide.
Why is content important for my blog?
Each piece of content or each article translates into more visitors. More quality content equals to more visitors.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5405-i-will-write-10-quality-vape-articles-for-your-blog
Are you looking to make your e-liquid or vape brand a global success? Do you want to see your e-liquid or vape brand inside every shop around the world? Our global vape shop database will connect your vape brand with thousands of vape shops around the world and subsequently, increase your revenues and profit. Our global vape shop database has been compiled manually by our internal team over a long period of time through contacts gained at vape exhibitions and publicly available resources.
Do you ever wonder, how today's big e-juice brands became big? They did what mattered the most- approached vape stores and established a rapport with vape store owners. We see many excellent e-juice brands that still fail or do not do as well as they should, simply because they do not do what matters- SELL THEIR E-JUICE TO VAPE SHOPS! (this should be the ultimate goal of any vape-related business). Our Global Vape Shop Database connects the dots between e-juice brands and the vape shops!
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://theeliquidboutique.co.uk/products/global-vape-shop-database
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
Please send me your website url and up to 100 keywords you would like to rank for on the search engines. Please do not use any separators between keywords and enter one keyword per line please. I will deliver everything as soon as the work is finished.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5343-i-will-create-a-tailored-hemp-and-cbd-monthly-backlinks-package
The vape industry has grown exponentially since 2012. It all started off with the ego starter kits, then progressed to dripping and subohming and now we seem to have reached the heights of nicotine salts, shortfill e-liquids, CBD and Juul devices. Thousands of brick-and-mortar vape shops have opened all around the world. New online vape shop start-ups are emerging on a daily basis. The competition in the vape industry has become cut throat! Back in 2012, it was a breeze to rank for competitive vape keywords on most search engines whilst today, it is even becoming difficult to rank for local area post codes as every corner of every city seems to have a growing vape shop demographic.
We were the first vape SEO company in the world and we know the vape industry inside out. We have ranked some of the biggest e-juice brands since when they were starting out, vape shops that were to become some of the biggest chains in the country, vape wholesalers, event organisers and many other different types of vape sites. Our deep knowledge of the SEO and the vape industries allows us to understand the unique business models of our clients and exactly what it takes to rank a vape shop to the very top of the search engines.
WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE
As we have mentioned above, since working with many vape businesses, we have created a blueprint for ranking a site. We have gone through numerous trial and errors and know what works and what does not work. In the current SEO climate, major search engines are putting a greater emphasis on the overall domain authority and metrics of a site as well as brand and onsite visitor behaviour (browsing, click-throughs and bounces). We are constantly adjusting our package to ensure that all of our practices are closely attuned to the latest SEO best-practices and search engine algorithms.
HERE IS WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE AND WHY IT IS IMPORTANT FOR YOUR SITE:
1,000 backlinks on vape and e-liquid blogs: all of the links are do follow, permanent and 100% related to the vaping niche. This helps the search engines to classify your site and rank it higher on the basis of the fact that it has a lot of links coming from designated vape blogs. Moreover, each vape blog has a very high domain authority which will pass on a lot of link equity to you site.
5,000+ forum posts: we will post out a unique message about your website or brand on the most popular forums in the world. Not only will this help to generate awareness about your brand but will also give you a lot of backlinks and direct visitors to your site.
Guest posts on very powerful sites: we have exclusive access to some very popular and powerful sites on which we can place guests posts with links to your site.
Mixed backlinks: in addition to the above work, we will also create some mixed backlinks for some diversity. This would include some blog comments, video comments and more.
Indexing: we will index your links with the major searhc engines at a very natural and steady pace to keep the search engine red flags at bay!
Learn more and buy at
https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
I will create backlinks on my e-liquid and vape blogs built on very high authority domains. Choose the package that most suits your budget and competition you are facing. All extras are highly recommended.
These vape backlinks will help to increase your vape shop's domain authority and search engine rankings as well as your sales.
Simply send me the keywords you would like to rank for and I will create individual blog posts on each vape blog and add a link to your site with your preferred anchor text. I will embed some vape-related images and video reviews.
All work is done manually using content related to your keywords.
All of my blogs are hosted on different servers and have different IP addresses.
Order now at https://bit.ly/2Vd2FqX
Hi guys
I was spoken to someone from your team some time ago about vape marketing.
As promised, I am sending you the link to the digital marketing company that helped to rank my online vape shop: https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
I hope this helps!
Have a fab day and see you very soon :)
The vape industry has grown exponentially since 2012. It all started off with the ego starter kits, then progressed to dripping and subohming and now we seem to have reached the heights of nicotine salts, shortfill e-liquids, CBD and Juul devices. Thousands of brick-and-mortar vape shops have opened all around the world. New online vape shop start-ups are emerging on a daily basis. The competition in the vape industry has become cut throat! Back in 2012, it was a breeze to rank for competitive vape keywords on most search engines whilst today, it is even becoming difficult to rank for local area post codes as every corner of every city seems to have a growing vape shop demographic.
We were the first vape SEO company in the world and we know the vape industry inside out. We have ranked some of the biggest e-juice brands since when they were starting out, vape shops that were to become some of the biggest chains in the country, vape wholesalers, event organisers and many other different types of vape sites. Our deep knowledge of the SEO and the vape industries allows us to understand the unique business models of our clients and exactly what it takes to rank a vape shop to the very top of the search engines.
WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE
As we have mentioned above, since working with many vape businesses, we have created a blueprint for ranking a site. We have gone through numerous trial and errors and know what works and what does not work. In the current SEO climate, major search engines are putting a greater emphasis on the overall domain authority and metrics of a site as well as brand and onsite visitor behaviour (browsing, click-throughs and bounces). We are constantly adjusting our package to ensure that all of our practices are closely attuned to the latest SEO best-practices and search engine algorithms.
HERE IS WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE AND WHY IT IS IMPORTANT FOR YOUR SITE:
1,000 backlinks on vape and e-liquid blogs: all of the links are do follow, permanent and 100% related to the vaping niche. This helps the search engines to classify your site and rank it higher on the basis of the fact that it has a lot of links coming from designated vape blogs. Moreover, each vape blog has a very high domain authority which will pass on a lot of link equity to you site.
5,000+ forum posts: we will post out a unique message about your website or brand on the most popular forums in the world. Not only will this help to generate awareness about your brand but will also give you a lot of backlinks and direct visitors to your site.
Guest posts on very powerful sites: we have exclusive access to some very popular and powerful sites on which we can place guests posts with links to your site.
Mixed backlinks: in addition to the above work, we will also create some mixed backlinks for some diversity. This would include some blog comments, video comments and more.
Indexing: we will index your links with the major searhc engines at a very natural and steady pace to keep the search engine red flags at bay!
Learn more and buy at
https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
A DEFINITIVE AND MOST COMPREHENSIVE E-MAIL LIST OF ALL VAPE SHOPS, E-LIQUID BRANDS, E-LIQUID WHOLESALERS, VAPE DISTRIBUTORS, VAPE EVENT ORGANISERS, ONLINE VAPE SHOPS, BRICK-AND-MORTAR VAPE SHOPS, VAPE MAGAZINES AND VAPE COMMUNITIES IS FINALLY HERE!
Following multiple requests from our clients, our e-mail marketing team has worked hard over the past three months to bring you an e-mail list of ALL vape businesses around the world. We have combined all e-mail addresses from our vape shop databases, contacts, business cards from over 50 vape exhibitions, public domain, subscriber lists and other sources. Our entire mailing list has been scrubbed to weed out vape businesses that have gone out of business or changed their domain names to bring you a clean and verified mailing list of vape businesses around the world. Upon payment, the Vape Company E-Mail Mailing List is available as an INSTANT DOWNLOAD in a notepad .txt format that you can simply upload to your subscriber list. Then all you have to do is create a beautiful newsletter campaign and hit the send button. Our Vape Company E-Mail Mailing List has over 38,000 email addresses of brick-and-mortar vape shops, e-liquid wholesalers and distributors, online vape shops, e-liquid brands, vape event organisers, vape communities, vape magazines, vape reviewers and much more! Our team is constantly verifying and updating the Vape Company email list to bring you only the latest vape company leads.
DOWNLOAD A SAMPLE OF OUR GLOBAL E-MAIL LIST OF ALL VAPE COMPANIES IN THE WORLD
https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
Good morning
I am looking to build up my B2B email list for newsletter marketing.
I am very keen to get Ivy's B2B Leads Miner - Yellow Pages Scraper Software as it is probably one of the best Yellow Pages scrapers for UK and USA out there.
I was just wondering if you have ever used this particular or any other scrapers before?
Cheers guys!
WORLD'S #1 UK VAPE SHOP DATABASE
Do you own an e-liquid or a vape brand? Are you looking to sell your product to vape shops directly? Our UK vape store database is the best and most important investment you will make for your vape business. There is simply no point of having a beautiful website and a great brand if nobody has heard of it or will never see it. Our vape shop database will help to connect your brand with vape stores which will equal to brand exposure, higher sales and greater profit. Just over 500 e-liquid and mod brands have purchased our database and have made significant gains. Some of these brands are already so large that you will have heard of them! Our database of UK vape shops will help you to expand your target audience. There are many ways in which you can use the UK vape shop database including vape email marketing campaigns, newsletters, telemarketing, sending of e-liquid samples, vape shop visits and much more!
https://theeliquidboutique.co.uk/products/uk-vape-shop-database
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
The vape industry has grown exponentially since 2012. It all started off with the ego starter kits, then progressed to dripping and subohming and now we seem to have reached the heights of nicotine salts, shortfill e-liquids, CBD and Juul devices. Thousands of brick-and-mortar vape shops have opened all around the world. New online vape shop start-ups are emerging on a daily basis. The competition in the vape industry has become cut throat! Back in 2012, it was a breeze to rank for competitive vape keywords on most search engines whilst today, it is even becoming difficult to rank for local area post codes as every corner of every city seems to have a growing vape shop demographic.
We were the first vape SEO company in the world and we know the vape industry inside out. We have ranked some of the biggest e-juice brands since when they were starting out, vape shops that were to become some of the biggest chains in the country, vape wholesalers, event organisers and many other different types of vape sites. Our deep knowledge of the SEO and the vape industries allows us to understand the unique business models of our clients and exactly what it takes to rank a vape shop to the very top of the search engines.
WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE
As we have mentioned above, since working with many vape businesses, we have created a blueprint for ranking a site. We have gone through numerous trial and errors and know what works and what does not work. In the current SEO climate, major search engines are putting a greater emphasis on the overall domain authority and metrics of a site as well as brand and onsite visitor behaviour (browsing, click-throughs and bounces). We are constantly adjusting our package to ensure that all of our practices are closely attuned to the latest SEO best-practices and search engine algorithms.
HERE IS WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE AND WHY IT IS IMPORTANT FOR YOUR SITE:
1,000 backlinks on vape and e-liquid blogs: all of the links are do follow, permanent and 100% related to the vaping niche. This helps the search engines to classify your site and rank it higher on the basis of the fact that it has a lot of links coming from designated vape blogs. Moreover, each vape blog has a very high domain authority which will pass on a lot of link equity to you site.
5,000+ forum posts: we will post out a unique message about your website or brand on the most popular forums in the world. Not only will this help to generate awareness about your brand but will also give you a lot of backlinks and direct visitors to your site.
Guest posts on very powerful sites: we have exclusive access to some very popular and powerful sites on which we can place guests posts with links to your site.
Mixed backlinks: in addition to the above work, we will also create some mixed backlinks for some diversity. This would include some blog comments, video comments and more.
Indexing: we will index your links with the major searhc engines at a very natural and steady pace to keep the search engine red flags at bay!
Learn more and buy at
https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
A DEFINITIVE AND MOST COMPREHENSIVE E-MAIL LIST OF ALL VAPE SHOPS, E-LIQUID BRANDS, E-LIQUID WHOLESALERS, VAPE DISTRIBUTORS, VAPE EVENT ORGANISERS, ONLINE VAPE SHOPS, BRICK-AND-MORTAR VAPE SHOPS, VAPE MAGAZINES AND VAPE COMMUNITIES IS FINALLY HERE!
Following multiple requests from our clients, our e-mail marketing team has worked hard over the past three months to bring you an e-mail list of ALL vape businesses around the world. We have combined all e-mail addresses from our vape shop databases, contacts, business cards from over 50 vape exhibitions, public domain, subscriber lists and other sources. Our entire mailing list has been scrubbed to weed out vape businesses that have gone out of business or changed their domain names to bring you a clean and verified mailing list of vape businesses around the world. Upon payment, the Vape Company E-Mail Mailing List is available as an INSTANT DOWNLOAD in a notepad .txt format that you can simply upload to your subscriber list. Then all you have to do is create a beautiful newsletter campaign and hit the send button. Our Vape Company E-Mail Mailing List has over 38,000 email addresses of brick-and-mortar vape shops, e-liquid wholesalers and distributors, online vape shops, e-liquid brands, vape event organisers, vape communities, vape magazines, vape reviewers and much more! Our team is constantly verifying and updating the Vape Company email list to bring you only the latest vape company leads.
DOWNLOAD A SAMPLE OF OUR GLOBAL E-MAIL LIST OF ALL VAPE COMPANIES IN THE WORLD
https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
HEMP AND CBD SEO BACKLINKS PACKAGE
The hemp and CBD industry has grown exponentially over the last few years. CBD products are now gaining mainstream acceptance all over the world. For example, in the UK, you can now freely purchase CBD eliquid, gummies, creams and oils at Holland and Barrett, one of the most popular health food shops. With this popularity of CBD and hemp products, comes the competition between online businesses. Are you looking to rank higher on the major search engines such as Google and Bing? Do you want to get more visitors and generate more sales? We can certainly help you!
Our Hemp and CBD SEO Backlinks Package will help to rank your hemp, cbd or cannabis related site all the way to the top of the search engines. With this SEO package, you will receive a wide variety of backlinks from quality CBD and hemp blogs, forums, guest posts and other quality sites! Boost your visitor counts, sales and online presence!
HOW OUR HEMP AND CBD SEO BACKLINKS PACKAGE CAN HELP YOUR BUSINESS
Having a great CBD or Hemp site is only a part of the equation. However, you need visitors to see your awesome site. In today's digital marketing landscape, Google and other major search engines have started to rank websites with a high domain authority and solid domain metrics. The best way to increase your domain authority and metrics is by building quality backlinks.
WHAT YOU WILL RECEIVE WITH OUR BACKLINKS PACKAGE
1,000 posts on CBD and hemp blogs: this will present you with very powerful and niche-relevant backlinks from very high DA sites ranging from 30 to 70.
10,000 forum posts: we will promote your message on 10,000 most powerful forums in the world. This is an excellent way to start a conversation with people and promote your CBD brand and attract direct visitors to your site! Moreover, this is your opportunity to get backlinks from some of the leading forums in the world!
Guest posts on authority sites: we have an arrangement with some of the leading and most powerful sites on which we will be able to publish guest posts with backlinks pointing to your site.
500 social bookmarks: social bookmarks are a great way of sending social signals to your site which is one of the ranking factors.
Indexing of all backlinks: we will index all of the links with the major search engines.
KEY FEATURES OF OUR HEMP AND CBD SEO BACKLINKS PACKAGE
Search Engine Safe: we use the industry's recommended ratio of naked, keyword, branded and LSI anchor texts to keep everything looking natural to the search engines.
Link Diversity: we create links on many different CMS platforms, domains and IP addresses to keep all the links as diverse as possible.
Drip-Feed Indexing: we will index all the backlinks at a very steady speed to keep everything looking natural to the search engines.
SHOW ME SOME EXAMPLES
We are currently working with 50 CBD companies on their SEO projects. Here are a few examples of the links we have created for some of our clients.
Click here to view the backlinks created for mountainside-medical.com
Click here to view the backlinks created for plantandhemp.com
PLACING AN ORDER
If you like what you see and would like to place an order, here is what you will need to do:
Buy the package
Prepare a list of 50 keywords you would like to rank for on the search engines and send us your website along with your company details including your name, official email, telephone number, company address and other information that you deem relevant.
Please send everything to us via our Facebook page (https://www.facebook.com/wowitloveithaveit/). We are more responsive on our social media pages.
We will create all your backlinks and will send you reports in about 30 days as this is a monthly package.
https://wowitloveithaveit.com/products/hemp-and-cbd-seo-backlinks-package
Hi guys
I can scrape all the vape shops in your country using my very powerful servers, thousands of dedicated proxies and my custom built software.
I will scrape the likes of Google maps, Yellow Pages, Search Engines and other places.
Scraping your own leads is by far the best way to get fresh and up-to-date leads than buying pre-made vape shop databases and email lists.
If your country is not listed, please order the UK gig if you are based in Europe. For other places, please order the Canada gig.
You will receive an Excel spreadsheet with:
vape shop names
addresses
e-mails
telephone numbers
social media links
websites
*provided vape shops contain this data.
Just to let you know, the software that I will be using is Yoggy's Money Vault Search Engine Scraper and E-Mail Extractor. This is literally the most powerful web scraper in the world that can produce insanely accurate and comprehensive leads!
You can learn more and order at https://www.fiverr.com/natalycox/scrape-vape-shop-emails-and-leads-for-you
Cheers
Hi
I have noticed that your site has a few links from some quality CBD blogs.
Are you by any means using this CBD SEO backlinks package? https://wowitloveithaveit.com/products/hemp-and-cbd-seo-backlinks-package
I am starting out with my CBD gummies site and need to invest in SEO to rank well on Google but I thought I would check in with you first.
I really appreciate your help.
Regards
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
Hello
I wanted to ask for your opinion about the monthly CBD backlink seo package. I can see that you have a backlink from https://wowitloveithaveit.com so I assume that you are working with those guys?
I just want to make an informed decision before ordering and thought that there is no better way than to ask some CBD companies in the industry.
I think this is the link https://wowitloveithaveit.com/products/hemp-and-cbd-seo-backlinks-package
I really appreciate your help!
Thank you!
I am currently working with some of the biggest vape wholesalers, MOD makers, e-juice brands and vape shops. I am sure that you have heard of them all or seen them at most vape expos. To put it bluntly, I know what works and what doesn't. I now know the vape industry like the back of my hand.
I have taken all the most effective elements of my vape seo equation and lumped them into these incredibly cheap packages, which I would sell for about 10 times the amount I am selling them for here.
I have divided the packages on the basis of the amount of competition you are facing. So here is the breakdown of what exactly you will get with each package:
Mouse (ideal for small local vape shops located in the suburbs):
100 links inside my vape and ejuice blogs
50 bookmarks and social signals
Indexing
Cat (mid-sized vape companies)
500 backlinks inside vape blogs
250 social bookmarks
promotion on 5,000 forums
Around 10,000 mixed blog comment, PBN and other links to increase your domain authority
Bear (ideal for companies based in large cities)
1500 vapor blog links
500 social bookmarks
Promotion on 10,000 forums
20,000 mixed links
Indexing
Guest Posts on 5 strong sites
Lots of Extras
To learn more, please visit https://www.fiverr.com/ghosttownseo/create-a-full-vape-backlinks-package
Hi!
I wanted to ask you if you have heard of this vape seo package (https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-for-shops-seo)?
I was told that many leading companies in the industry are using it with the likes of vapor dna, vape ranger, element eliquids, ie vapor, ejuices.co, marina vape and other big players.
I just wanted to check whether you have used them before as I can see that you have a backlink from https://wowitloveithaveit.com so my natural assumption is that you are working with these guys.
Would you recommend them?
Cheers
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
Hi guys
I can scrape all the vape shops in your country using my very powerful servers, thousands of dedicated proxies and my custom built software.
I will scrape the likes of Google maps, Yellow Pages, Search Engines and other places.
Scraping your own leads is by far the best way to get fresh and up-to-date leads than buying pre-made vape shop databases and email lists.
If your country is not listed, please order the UK gig if you are based in Europe. For other places, please order the Canada gig.
You will receive an Excel spreadsheet with:
vape shop names
addresses
e-mails
telephone numbers
social media links
websites
*provided vape shops contain this data.
Just to let you know, the software that I will be using is Yoggy's Money Vault Search Engine Scraper and E-Mail Extractor. This is literally the most powerful web scraper in the world that can produce insanely accurate and comprehensive leads!
You can learn more and order at https://www.fiverr.com/natalycox/scrape-vape-shop-emails-and-leads-for-you
Cheers
Are you looking to make your e-liquid or vape brand a global success? Do you want to see your e-liquid or vape brand inside every shop around the world? Our global vape shop database will connect your vape brand with thousands of vape shops around the world and subsequently, increase your revenues and profit. Our global vape shop database has been compiled manually by our internal team over a long period of time through contacts gained at vape exhibitions and publicly available resources.
Do you ever wonder, how today's big e-juice brands became big? They did what mattered the most- approached vape stores and established a rapport with vape store owners. We see many excellent e-juice brands that still fail or do not do as well as they should, simply because they do not do what matters- SELL THEIR E-JUICE TO VAPE SHOPS! (this should be the ultimate goal of any vape-related business). Our Global Vape Shop Database connects the dots between e-juice brands and the vape shops!
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://theeliquidboutique.co.uk/products/global-vape-shop-database
I am currently working with some of the biggest vape wholesalers, MOD makers, e-juice brands and vape shops. I am sure that you have heard of them all or seen them at most vape expos. To put it bluntly, I know what works and what doesn't. I now know the vape industry like the back of my hand.
I have taken all the most effective elements of my vape seo equation and lumped them into these incredibly cheap packages, which I would sell for about 10 times the amount I am selling them for here.
I have divided the packages on the basis of the amount of competition you are facing. So here is the breakdown of what exactly you will get with each package:
Mouse (ideal for small local vape shops located in the suburbs):
100 links inside my vape and ejuice blogs
50 bookmarks and social signals
Indexing
Cat (mid-sized vape companies)
500 backlinks inside vape blogs
250 social bookmarks
promotion on 5,000 forums
Around 10,000 mixed blog comment, PBN and other links to increase your domain authority
Bear (ideal for companies based in large cities)
1500 vapor blog links
500 social bookmarks
Promotion on 10,000 forums
20,000 mixed links
Indexing
Guest Posts on 5 strong sites
Lots of Extras
To learn more, please visit https://www.fiverr.com/ghosttownseo/create-a-full-vape-backlinks-package
Good Afternoon
I am writing to you to introduce my freelance vape seo services. I specialise in creating quality vape-related links to rank vape-related sites on search engines such as Google. I work with 50 of the leading vape shops, e-juice brands and wholesalers and now I have decided to take the same package that we provide to clients via an agency and offer it ten times cheaper on Fiverr.
Please take a look at the package and if it is of interest, please feel free to order it from https://www.fiverr.com/cryptovaper
Thank you for your time.
Kind regards
Sergey
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
A DEFINITIVE AND MOST COMPREHENSIVE E-MAIL LIST OF ALL VAPE SHOPS, E-LIQUID BRANDS, E-LIQUID WHOLESALERS, VAPE DISTRIBUTORS, VAPE EVENT ORGANISERS, ONLINE VAPE SHOPS, BRICK-AND-MORTAR VAPE SHOPS, VAPE MAGAZINES AND VAPE COMMUNITIES IS FINALLY HERE!
Following multiple requests from our clients, our e-mail marketing team has worked hard over the past three months to bring you an e-mail list of ALL vape businesses around the world. We have combined all e-mail addresses from our vape shop databases, contacts, business cards from over 50 vape exhibitions, public domain, subscriber lists and other sources. Our entire mailing list has been scrubbed to weed out vape businesses that have gone out of business or changed their domain names to bring you a clean and verified mailing list of vape businesses around the world. Upon payment, the Vape Company E-Mail Mailing List is available as an INSTANT DOWNLOAD in a notepad .txt format that you can simply upload to your subscriber list. Then all you have to do is create a beautiful newsletter campaign and hit the send button. Our Vape Company E-Mail Mailing List has over 38,000 email addresses of brick-and-mortar vape shops, e-liquid wholesalers and distributors, online vape shops, e-liquid brands, vape event organisers, vape communities, vape magazines, vape reviewers and much more! Our team is constantly verifying and updating the Vape Company email list to bring you only the latest vape company leads.
DOWNLOAD A SAMPLE OF OUR GLOBAL E-MAIL LIST OF ALL VAPE COMPANIES IN THE WORLD
https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
Hi guys
We are excited to let you know that we have now officially launched our CBD and Hemp Backlinks package. Previously, we have worked with some of the biggest CBD companies behind closed doors. However, we have made a decision to make our Hemp and CBD SEO Backlinks package public and accessible to everyone!
We would like to invite you to review our package and see how it could benefit your business: https://wowitloveithaveit.com/products/hemp-and-cbd-seo-backlinks-package
Our backlinks package has been tried and tested on some of the heaviest hitting CBD companies in the industry and provides an excellent blueprint for ranking almost any type of CBD and hemp site!
We have added some example links that we have created for some of our clients for you to get an idea of the links.
The package is currently on offer so you can land yourself a pretty good bargain.
Do let us know if you have any questions!
Thanks :)
Content marketing is extremely important for increasing your website traffic as well as your SEO rankings. Right now, the major search engines are looking at how long visitors are spending on your site to decide how to rank your site.
It is extremely important to have QUALITY blog posts that are interesting to read and add value to your site. As my experience has shown, poor quality spun articles will get you nowhere.
I have been involved in the vape market for the past 7 years and know pretty much everything about it, including all the major vape companies, e-juice brands, vape mods, nicotine salts, vape laws and more.
With this service, I will write up articles for your blog. I recommend that you keep your article titles relatively broad instead of focusing too much on individual products. Each piece will be conversational, well-researched and fun to read.
Simply send me your article titles and leave everything else to me.
Frequently Asked Questions
I need more than 10 articles.
You can order multiple packages or I could send you a custom offer, whichever works best for you.
What makes you a good writer?
My knowledge of the vape industry is what gives me an unparalleled advantage over other writers who have no experience in this field. Instead of writing the bare basics about the vape market, I can also write very critical and in-depth pieces.
Can you help me to come up with the topics?
Absolutely. Just send me your site and tell me a bit more about your business and I will put together some prospective titles.
How do I choose my blog titles?
I would recommend that you do not choose very broad article titles such as what is vaping because it will be very difficult to rank this article on the search engines due to the high keyword competition. Try to stick to more specialised titles such as nicotine salts guide.
Why is content important for my blog?
Each piece of content or each article translates into more visitors. More quality content equals to more visitors.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5405-i-will-write-10-quality-vape-articles-for-your-blog
Good Afternoon
I am writing to you to introduce my freelance vape seo services. I specialise in creating quality vape-related links to rank vape-related sites on search engines such as Google. I work with 50 of the leading vape shops, e-juice brands and wholesalers and now I have decided to take the same package that we provide to clients via an agency and offer it ten times cheaper on Fiverr.
Please take a look at the package and if it is of interest, please feel free to order it from https://www.fiverr.com/cryptovaper
Thank you for your time.
Kind regards
Sergey
Hello
I am writing to briefly introduce my CBD and Hemp backlinks packages.
I used to work for a London based SEO and digital marketing agency but I have decided to leave and start freelancing instead.
I am offering exactly the same package sold by most SEO agencies but ten times cheaper.
Having worked for an SEO agency, I know what works and what doesn't insofar as SEO goes.
Please take a look at my services here: https://www.fiverr.com/summerinwapping
If you are interested, please feel free to place an order or message me for details.
Have a great day!
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
Please send me your website url and up to 100 keywords you would like to rank for on the search engines. Please do not use any separators between keywords and enter one keyword per line please. I will deliver everything as soon as the work is finished.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5343-i-will-create-a-tailored-hemp-and-cbd-monthly-backlinks-package
Content marketing is extremely important for increasing your website traffic as well as your SEO rankings. Right now, the major search engines are looking at how long visitors are spending on your site to decide how to rank your site.
It is extremely important to have QUALITY blog posts that are interesting to read and add value to your site. As my experience has shown, poor quality spun articles will get you nowhere.
I have been involved in the vape market for the past 7 years and know pretty much everything about it, including all the major vape companies, e-juice brands, vape mods, nicotine salts, vape laws and more.
With this service, I will write up articles for your blog. I recommend that you keep your article titles relatively broad instead of focusing too much on individual products. Each piece will be conversational, well-researched and fun to read.
Simply send me your article titles and leave everything else to me.
Frequently Asked Questions
I need more than 10 articles.
You can order multiple packages or I could send you a custom offer, whichever works best for you.
What makes you a good writer?
My knowledge of the vape industry is what gives me an unparalleled advantage over other writers who have no experience in this field. Instead of writing the bare basics about the vape market, I can also write very critical and in-depth pieces.
Can you help me to come up with the topics?
Absolutely. Just send me your site and tell me a bit more about your business and I will put together some prospective titles.
How do I choose my blog titles?
I would recommend that you do not choose very broad article titles such as what is vaping because it will be very difficult to rank this article on the search engines due to the high keyword competition. Try to stick to more specialised titles such as nicotine salts guide.
Why is content important for my blog?
Each piece of content or each article translates into more visitors. More quality content equals to more visitors.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5405-i-will-write-10-quality-vape-articles-for-your-blog
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
GLOBAL VAPE COMPANY EMAIL LIST OF VAPE SHOPS AND VAPE WHOLESALERS AND E-LIQUID DISTRIBUTORS
Global Vape Company Email List of Vape Shops and Vape Wholesalers and E-Liquid Distributors
Did you know that there are over 38,000 vape companies around the world that you can contact today? Whether you run an e-liquid line or a vape wholesale business, these vape company emails can help you to reach practically all vape companies with your message. Are you tired from not making enough B2B sales to vape shops and vape wholesalers? Do you find most of your marketing to be unproductive? Do you want to take your vape business to the next level and start exploding your sales? Here is the secret sauce that has helped over 500 e-liquid brands and wholesalers from around the world since 2012! Some ejuice companies have even tried to buy us out because they felt that the accessibility of this list was putting them against a lot of competition from smaller vape companies and e-liquid brands! This hopefully helps to illustrate just how powerful this vape company email list is!
HERE IS WHAT THE VAPE COMPANY EMAIL LIST CONTAINS:
Vape Shops (brick-and-mortar and online)
Vape Wholesalers and distributors
E-Liquid Companies
Vape Event Organisers
Vape magazines
Vape reviewers
HERE ARE THE WAYS IN WHICH YOU CAN USE THIS VAPE COMPANY EMAIL LIST
Promotional messages
Introductory emails
Guest post outreach for backlink building
Much more
Buy and learn more at https://bit.ly/2zcDKeX
Hey guys!
I just wanted to check in with you whether you need any SEO / lead generation services at the moment?
I have a pretty good working knowledge of the vape and CBD niches as I have been in this game for 7 years and have helped to rank some of today's leading sites.
I can do all sorts of things such as monthly backlink packages, writing blog articles, scraping leads for your business, doing an outreach, promoting you on leading vape and cbd publications and so on!
You can buy my links / chat to me here https://www.fiverr.com/ghosttownseo (this is a freelance site).
Cheers guys!
Hello guys!
I am dropping you a quick line to introduce you to my services.
Unfortunately, due to Brexit, I was laid off by an SEO agency so I decided to freelance instead.
I have worked with a lot of CBD and hemp online retailers based in the UK and USA and therefore have a very good understanding of what is needed to rank your site at the top of Google.
I am also good at lead gen and have managed to put together a database of all the CBD and hemp stores, manufacturers and wholesalers.
I have organised my packages thematically.
You can view and order my packages from here: https://www.fiverr.com/canarywharfseo
Have a fab day! :) I am back to my CBD gummy bears!
Hey guys!
I just wanted to check in with you whether you need any SEO / lead generation services at the moment?
I have a pretty good working knowledge of the vape and CBD niches as I have been in this game for 7 years and have helped to rank some of today's leading sites.
I can do all sorts of things such as monthly backlink packages, writing blog articles, scraping leads for your business, doing an outreach, promoting you on leading vape and cbd publications and so on!
You can buy my links / chat to me here https://www.fiverr.com/ghosttownseo (this is a freelance site).
Cheers guys!
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
A DEFINITIVE AND MOST COMPREHENSIVE E-MAIL LIST OF ALL VAPE SHOPS, E-LIQUID BRANDS, E-LIQUID WHOLESALERS, VAPE DISTRIBUTORS, VAPE EVENT ORGANISERS, ONLINE VAPE SHOPS, BRICK-AND-MORTAR VAPE SHOPS, VAPE MAGAZINES AND VAPE COMMUNITIES IS FINALLY HERE!
Following multiple requests from our clients, our e-mail marketing team has worked hard over the past three months to bring you an e-mail list of ALL vape businesses around the world. We have combined all e-mail addresses from our vape shop databases, contacts, business cards from over 50 vape exhibitions, public domain, subscriber lists and other sources. Our entire mailing list has been scrubbed to weed out vape businesses that have gone out of business or changed their domain names to bring you a clean and verified mailing list of vape businesses around the world. Upon payment, the Vape Company E-Mail Mailing List is available as an INSTANT DOWNLOAD in a notepad .txt format that you can simply upload to your subscriber list. Then all you have to do is create a beautiful newsletter campaign and hit the send button. Our Vape Company E-Mail Mailing List has over 38,000 email addresses of brick-and-mortar vape shops, e-liquid wholesalers and distributors, online vape shops, e-liquid brands, vape event organisers, vape communities, vape magazines, vape reviewers and much more! Our team is constantly verifying and updating the Vape Company email list to bring you only the latest vape company leads.
DOWNLOAD A SAMPLE OF OUR GLOBAL E-MAIL LIST OF ALL VAPE COMPANIES IN THE WORLD
https://theeliquidboutique.co.uk/products/vape-company-e-mail-mailing-list
After many requests from my clients, I have created this monthly backlinks SEO package for CBD and Hemp businesses. Essentially, the premium package contains everything that you will need to rank higher on the search engines, get more visitors and make more sales. I am working with 50 different CBD and Hemp companies and during my digital marketing journey, I have tried and tested almost every strategy under the sun and picked out the bits that work real magic and chucked them all into a dirt cheap package.
Depending on the package that you order, here is what you will receive:
Posts and links on CBD and Hemp blog: these will provide you with contextual and extremely powerful links that will tell the search engines that your site is very popular in this niche which will force the search engines to rank you up!
Promotion of your brand/site on over 10,000 most popular forums in the world: you will receive links, direct traffic to your site and generate brand awareness.
Guest posts: I will post articles on popular sites and add links to your site.
Paid promotions on popular sites.
Social media signals.
Many more extras!
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5344-i-will-create-a-tailored-monthly-vape-seo-backlinks-package
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
Hey guys
I am dropping you a line to quickly introduce my hemp and CBD marketing packages.
Whilst doing some research for my existing clients, I came across your site and thought I would write to you to see if you are interested in my CBD and hemp focused packages.
My main area of specialisation is sponsored guest posting on vape and cbd blogs as well as business directories.
I am currently working with some of the industry leaders.
I used to work for a reputable SEO agency but have abandoned the ship since a couple of months ago.
With me, you will get a competitively-priced service with a friendly approach.
You can view and order my packages from Fiverr https://www.fiverr.com/autumninchelsea
For ease of communication, please write to me on Fiverr as I have my auto notifications enabled.
I recommend my monthly package with all extras as it literally contains virtually everything you need to rank.
I look forward to working with you!
Cheers
Content marketing is extremely important for increasing your website traffic as well as your SEO rankings. Right now, the major search engines are looking at how long visitors are spending on your site to decide how to rank your site.
It is extremely important to have QUALITY blog posts that are interesting to read and add value to your site. As my experience has shown, poor quality spun articles will get you nowhere.
I have been involved in the vape market for the past 7 years and know pretty much everything about it, including all the major vape companies, e-juice brands, vape mods, nicotine salts, vape laws and more.
With this service, I will write up articles for your blog. I recommend that you keep your article titles relatively broad instead of focusing too much on individual products. Each piece will be conversational, well-researched and fun to read.
Simply send me your article titles and leave everything else to me.
Frequently Asked Questions
I need more than 10 articles.
You can order multiple packages or I could send you a custom offer, whichever works best for you.
What makes you a good writer?
My knowledge of the vape industry is what gives me an unparalleled advantage over other writers who have no experience in this field. Instead of writing the bare basics about the vape market, I can also write very critical and in-depth pieces.
Can you help me to come up with the topics?
Absolutely. Just send me your site and tell me a bit more about your business and I will put together some prospective titles.
How do I choose my blog titles?
I would recommend that you do not choose very broad article titles such as what is vaping because it will be very difficult to rank this article on the search engines due to the high keyword competition. Try to stick to more specialised titles such as nicotine salts guide.
Why is content important for my blog?
Each piece of content or each article translates into more visitors. More quality content equals to more visitors.
https://peachesandscreams.co.uk/community/peaches/forums/881-vape-forum-new/topics/5405-i-will-write-10-quality-vape-articles-for-your-blog
WORLD'S #1 UK VAPE SHOP DATABASE
Do you own an e-liquid or a vape brand? Are you looking to sell your product to vape shops directly? Our UK vape store database is the best and most important investment you will make for your vape business. There is simply no point of having a beautiful website and a great brand if nobody has heard of it or will never see it. Our vape shop database will help to connect your brand with vape stores which will equal to brand exposure, higher sales and greater profit. Just over 500 e-liquid and mod brands have purchased our database and have made significant gains. Some of these brands are already so large that you will have heard of them! Our database of UK vape shops will help you to expand your target audience. There are many ways in which you can use the UK vape shop database including vape email marketing campaigns, newsletters, telemarketing, sending of e-liquid samples, vape shop visits and much more!
https://theeliquidboutique.co.uk/products/uk-vape-shop-database
The vape industry has grown exponentially since 2012. It all started off with the ego starter kits, then progressed to dripping and subohming and now we seem to have reached the heights of nicotine salts, shortfill e-liquids, CBD and Juul devices. Thousands of brick-and-mortar vape shops have opened all around the world. New online vape shop start-ups are emerging on a daily basis. The competition in the vape industry has become cut throat! Back in 2012, it was a breeze to rank for competitive vape keywords on most search engines whilst today, it is even becoming difficult to rank for local area post codes as every corner of every city seems to have a growing vape shop demographic.
We were the first vape SEO company in the world and we know the vape industry inside out. We have ranked some of the biggest e-juice brands since when they were starting out, vape shops that were to become some of the biggest chains in the country, vape wholesalers, event organisers and many other different types of vape sites. Our deep knowledge of the SEO and the vape industries allows us to understand the unique business models of our clients and exactly what it takes to rank a vape shop to the very top of the search engines.
WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE
As we have mentioned above, since working with many vape businesses, we have created a blueprint for ranking a site. We have gone through numerous trial and errors and know what works and what does not work. In the current SEO climate, major search engines are putting a greater emphasis on the overall domain authority and metrics of a site as well as brand and onsite visitor behaviour (browsing, click-throughs and bounces). We are constantly adjusting our package to ensure that all of our practices are closely attuned to the latest SEO best-practices and search engine algorithms.
HERE IS WHAT YOU WILL RECEIVE WITH OUR VAPE SEO PACKAGE AND WHY IT IS IMPORTANT FOR YOUR SITE:
1,000 backlinks on vape and e-liquid blogs: all of the links are do follow, permanent and 100% related to the vaping niche. This helps the search engines to classify your site and rank it higher on the basis of the fact that it has a lot of links coming from designated vape blogs. Moreover, each vape blog has a very high domain authority which will pass on a lot of link equity to you site.
5,000+ forum posts: we will post out a unique message about your website or brand on the most popular forums in the world. Not only will this help to generate awareness about your brand but will also give you a lot of backlinks and direct visitors to your site.
Guest posts on very powerful sites: we have exclusive access to some very popular and powerful sites on which we can place guests posts with links to your site.
Mixed backlinks: in addition to the above work, we will also create some mixed backlinks for some diversity. This would include some blog comments, video comments and more.
Indexing: we will index your links with the major searhc engines at a very natural and steady pace to keep the search engine red flags at bay!
Learn more and buy at
https://wowitloveithaveit.com/products/extra-powerful-vape-backlinks-seo-package-for-shops
A QUICK OVERVIEW OF OUR GLOBAL VAPE SHOP DATABASE
Our Global Vape Shop Database contains vape shop contact details including:
vape shop names
e-mails
telephone numbers
websites
social media links
locations/physical addresses
Our Global Vape Shop Database comes in an Excel spreadsheet with vape shop details grouped by country in separate worksheets. You will receive the Global Vape Shop Database in a compressed .rar file. Simply extract the document using Windows .rar or an alternative extractor. These can be downloaded online in a click of a button.
Our Global Vape Shop Database has been going for the past 5 years! Our team regularly attend vape exhibitions and events. They use this as an opportunity to collect vape shop contact details. Most of the vape shop leads are available online. However, finding, verifying and compiling them is a real administrative burden and we tell you that from our 5 year-long experience in this industry!
A QUICK BREAKDOWN OF OUR GLOBAL VAPE SHOP DATABASE
Our database covers USA, UK, Europe, Russia and CIS, parts of Asia, Australasia and Africa. Here's a non-exhaustive list of countries covered:
Armenia, Australia, Austria, Azerbaijan, Bahrain, Bangladesh, Belgium , Canada, Czech Republic, Denmark, Estonia, Finland, France, Georgia, Germany, Greece , India, Indonesia, Ireland, Italy, Japan, Kazakhstan , Kyrgyzstan, Latvia, Lithuania, Malaysia, Maldives, Moldova, Netherlands, Poland, Romania, Russia, Slovakia, South Africa, Spain, Sweden, Switzerland, Tajikistan, UK , USA, Uzbekistan.
DOWNLOAD A SAMPLE OF OUR VAPE SHOP DATABASE
https://wowitloveithaveit.com/products/global-vape-shop-database-with-contact-details
Good Afternoon
I am writing to you to introduce my freelance vape seo services. I specialise in creating quality vape-related links to rank vape-related sites on search engines such as Google. I work with 50 of the leading vape shops, e-juice brands and wholesalers and now I have decided to take the same package that we provide to clients via an agency and offer it ten times cheaper on Fiverr.
Please take a look at the package and if it is of interest, please feel free to order it from https://www.fiverr.com/cryptovaper
Thank you for your time.
Kind regards
Sergey
Hey guys
I am dropping you a line to quickly introduce my vape, cbd and hemp marketing packages.
Whilst doing some research for my existing clients, I came across your site and thought I would write to you to see if you are interested in my vape, cbd and hemp focused packages.
My main area of specialisation is sponsored guest posting on vape and cbd blogs as well as business directories.
I am currently working with some of the industry leaders.
I used to work for a reputable SEO agency but have abandoned the ship since a couple of months ago.
With me, you will get a competitively-priced service with a friendly approach.
You can view and order my packages from Fiverr https://www.fiverr.com/autumninchelsea
For ease of communication, please write to me on Fiverr as I have my auto notifications enabled.
I recommend my monthly package with all extras as it literally contains virtually everything you need to rank.
I look forward to working with you!
Cheers
Dear Partner,
This is David Wright from Business Development Department Woorke, A Digital Marketing One Stop Shop
We would like to invite you to join our Affiliate Program just refer visitors to Woorke and earn 90% Commission for each Sale!
You can moniter the campaign through our Unique Dashboard and can track each records. You will get 150 day's cookie tracking and custom affiliate build available
Join our Affiliate Program and we are looking forward to your positive reply.
Best Regards
David Wright
Woorke
Dear team,
My name is David Wright, and I am the affiliate manager for Woorke, A Digital Marketing One Stop Shop
After reviewing your site, I definitely see a lot of potential to work together.
I would like to invite you to join our affiliate program at a starting commission rate of 90% on each Sale.
If you have any questions about our affiliate program, Please contact Us.
Looking forward to working with you.
Thanks,
David Wright
Affiliate Program Manager
I am a great fan of CBD and hemp products and I must admit that I know the market inside out.
With this very exclusive service, I will try and honestly review your products on the basis of their presentation, quality (taste: if edible), value for money, branding and so on.
I can review up to 50 products at most.
I am based in the UK, so you would have to ship all the products to my UK address.
I would publish the reviews in a CBD and Hemp lifestyle magazine. I can take pictures of your products and add them next to each product (see extra gig).
Depending on the number of products involved, I would write up around 1,500 to 3,000 words for the entire review. I would optimise the article for SEO and get it to rank for your brand name.
This is by far the most effective way of not only building your brand but also creating goodwill with your prospective clients. Nothing works better than real user reviews free of any corporate bias.
It will take me about a month to complete the review.
The review would be permanent and feature a link to your site.
https://www.fiverr.com/miniksseo/honestly-test-and-review-your-hemp-or-cbd-products
Hello Mate,
You are in SEO industry and ofcourse you want SEO Tools for your daily tasks, but buying all tools are very EXPENSIVE.
I am now OFFER you all SEO TOP TOOLS in just $27/month. INSTANT access after payment.
You can TRIAL the system for one day at just $1.
For more detail please visit: https://buyseotools.org
Regards,
I am a great fan of CBD and hemp products and I must admit that I know the market inside out.
With this very exclusive service, I will try and honestly review your products on the basis of their presentation, quality (taste: if edible), value for money, branding and so on.
I can review up to 50 products at most.
I am based in the UK, so you would have to ship all the products to my UK address.
I would publish the reviews in a CBD and Hemp lifestyle magazine. I can take pictures of your products and add them next to each product (see extra gig).
Depending on the number of products involved, I would write up around 1,500 to 3,000 words for the entire review. I would optimise the article for SEO and get it to rank for your brand name.
This is by far the most effective way of not only building your brand but also creating goodwill with your prospective clients. Nothing works better than real user reviews free of any corporate bias.
It will take me about a month to complete the review.
The review would be permanent and feature a link to your site.
https://www.fiverr.com/miniksseo/honestly-test-and-review-your-hemp-or-cbd-products
Hi guys
I am reaching out to you to see whether you would be interested in our CBD and vape shop databases?
At the moment, we have the following databases:
Global Vape Shop Database and Vape Store Email List
https://creativebeartech.com/product/global-vape-shop-database-and-vape-store-email-list/
Global Hemp and CBD Shops Database with Contact Details
https://creativebeartech.com/product/global-hemp-and-cbd-shops-database-with-contact-details/
A lot of ejuice and CBD brands, wholesalers and manufacturers are using our databases for expanding their B2B business. The list includes the likes of The Milkman, Five Pawns, CBD FX, Meet Harmony, Dinner Lady, Marina Vape, Ejuices.co and many others.
All of our databases are on promotion for another week.
Many thanks for your time and if you have any questions, please feel free to reach out to me!
Would you be interested in advertising that costs less than $40 monthly and sends tons of people who are ready to buy directly to your website? Please send me a reply here: lily5885mil@gmail.com and I'll send more details.
September 2019 - We have scraped a brand new CBD and Vape Shop Database. The brand new CBD and Vape Shop Database contains approximately 22,000 entries of vape and cbd shops, wholesalers, manufacturers and related businesses. We have decided to add the vape companies due to the close connection between CBD and vape products. An increasing number of CBD companies are now producing CBD vape juice and likewise, an increasing number of vape shops are selling CBD products such as CBD e-juices, gummies, salves, oil and others.
Learn more and download your latest copy of the database here: https://creativebeartech.com/product/global-hemp-and-cbd-shops-database-with-contact-details/
Are You interested in an advertising service that costs less than $50 monthly and sends thousands of people who are ready to buy directly to your website? Please send me a reply here: mia4675whi@gmail.com and I'll send more details.
www.elfdoll.co.jp - ăăăăŞă˘ăŤăŞé 形ďźć觌ăăčż˝ćąăăĺŽçžăŤćĺăăç躍大ăŞăŞă¸ăăŤăŠăăăźăŤăăăăăŻă¤ăă貊売ăăŚăăžăăăˇăźă ăŹăšăťăăźăŤăťăĄăźăŤăźăă˘ăŤăăăăŞă§ăă
ăŞă˘ăŤăăźăŤ ă¨ăŤăăăźăŤ
ăŞă˘ăŤăŠăăăźăŤ ă¨ăŤăăăźăŤ
ăŠăăăźăŤ ă¨ăŤăăăźăŤ
ă˘ăăŤăăăźăŤ ă¨ăŤăăăźăŤ
ăŞă˘ăŤăăźăŤ
ă˘ăăŤăăăźăŤ
Looking for effective online marketing that isn't full of BS? Sorry to bug you on your contact form but actually that was the whole point. We can send your promotional message to sites via their contact pages just like you're getting this ad right now. You can specify targets by keyword or just execute bulk blasts to sites in the country of your choice. So let's say you would like to blast an ad to all the interior decorators in the USA, we'll scrape websites for just those and post your promo to them. As long as you're advertising a product or service that's relevant to that business category then you'll get awesome results!
Send a reply to poppy8542bro@gmail.com for details on how this works
Dear Sir/Madam,
Have you obtained stunning e-mails from Amazon informing you that your listing is being ended as a result of infringe some brand name's license?
I fully recognized the anxiety and also disturbed when your finest marketing listing or shop was outlawed due to the fact that I am running a store in Amazon too!
It truly makes my heart pounding like crazy when obtaining those emails!
No fear now! As we obtained the innovation to recoup/ appeal your prohibited list. Initial price US$ 200.0/ listing
Please call: sales@bestapplestore.com
skype: live: sales_89588.
for quotation.
Appears increditable? Repayment by Paypal as well as 100% reimbursement to you otherwise sucessful. 100% protected and also self-confidence.
Best concerns,.
Matthew.
HKSEO Ltd.
HKSEO Established in 2010, we are specialized in SEO advertising as well as a leading Amazon company to clients in a wide variety of sectors.
Looking for fresh buyers? Get hundreds of people who are ready to buy sent directly to your website. Boost revenues quick. Start seeing results in as little as 48 hours. To get info send a reply to: leo6843will@gmail.com
Explode your B2B sales with our Global Vape Shop Database and Vape Store Email List. Our Global Vape Shop Database contains contact details of over 22,000 cbd and vape stores from around the world and will help you to connect with thousands of vape shops in a click of a button! Our vape shop leads comes in an Excel spreadsheet and cover the most of the world!
You will receive a copy of the Global Vape Shop Database and Vape Store Email List. This vape store database contains contact details for practically all the vape shops in English and non-English speaking countries, including USA, UK, Germany, France, Australia, South Africa, Canada, parts of Europe, Asia, Russia and CIS and the rest of the world.
The vape shop leads come in an Excel .csv file and contain the following data: emails, websites, telephone numbers, addresses and social media links. The e-cigarette shop database is ideal for connecting vape wholesalers, manufacturers and e-liquid brands with vape shops.
In addition to these vapor store leads, we also have individual databases of CBD stores, health food shops, convenience stores, supermarkets and an email list of ALL vape companies in the world. Our global vape shop database partially covers CBD shops because some vape shops sell CBD products.
The entire data base is created using our proprietary Search Engine Scraper by Creative Bear Tech, the most advanced website and search engine scraper on the market that allows us to scrape comprehensive and niche-targeted marketing lists.
https://creativebeartech.com/product/global-vape-shop-database-and-vape-store-email-list/
Hi
I have a question, i see a lot of products on this site
https://screenshot.photos/wholesale that you also sell in your store.
But there items are 23% cheaper,
well my question is what is the difference between your shop and theirs,
is it the quality or something else, i hope you can help me!
Sincerely
"Sent from my iPhone"
Are you trying to find effective online promotion that has no per click costs and will get you new customers fast? Sorry to bug you on your contact form but actually that was the whole point. We can send your advertising text to sites through their contact pages just like you're reading this ad right now. You can target by keyword or just execute mass blasts to websites in any country you choose. So let's assume you would like to push through a message to all the plumbing companies in the United States, we'll grab websites for only those and post your ad text to them. As long as you're advertising a product or service that's relevant to that type of business then your business will get an awesome result!
Send a quick message to alfred3545will@gmail.com to get info and prices
Are you trying to find powerful online marketing that has no per click costs and will get you new customers fast? I apologize for sending you this message on your contact form but actually that was the whole point. We can send your promotional text to sites through their contact pages just like you're receiving this note right now. You can specify targets by keyword or just execute bulk blasts to sites in the country of your choice. So let's assume you would like to blast an ad to all the real estate agents in the US, we'll scrape websites for just those and post your ad message to them. Providing you're advertising a product or service that's relevant to that type of business then you'll be blessed with an amazing response!
Send a reply to jacob3640wod@gmail.com to get details about how we do this
Dear Friend! How are you? I write to introduce our best vape backlink service. We have big team of professionals from Pakistan, India and Bangladesh who work cheap and do good job with backlinks. You just look at my profile and place order now! https://www.fiverr.com/rareair/send-you-info-for-37k-vape-stores-and-dispensaries-in-us-can
Dear Friend! How are you? I write to introduce our best vape backlink service. We have big team of professionals from Pakistan, India and Bangladesh who work cheap and do good job with backlinks. You just look at my profile and place order now! https://www.fiverr.com/arshadzaidi1813/do-guest-post-on-my-vaping-website
Dear Friend! How are you? I write to introduce our best vape backlink service. We have big team of professionals from Pakistan, India and Bangladesh who work cheap and do good job with backlinks. You just look at my profile and place order now! https://www.fiverr.com/webdeals24/give-your-ecig-vape-website-2-guest-posts-and-50-backlinks
Good evening, I was just on your site and filled out your feedback form. The feedback page on your site sends you these messages to your email account which is the reason you are reading my message right now correct? This is the holy grail with any type of online ad, making people actually READ your message and that's exactly what I just accomplished with you! If you have something you would like to promote to tons of websites via their contact forms in the U.S. or to any country worldwide let me know, I can even target your required niches and my costs are super reasonable. Send a reply to: harry2947har@gmail.com
List przeglad-urologiczny.pl with a VAPE STORE DIRECTORY to increase your online exposure and sales. Simply Google "VAPE STORE DIRECTORY".
List przeglad-urologiczny.pl with a CBD Shop Directory to increase your online exposure and sales. Simply Google "CBD Shop Directory".
Increase your B2B sales by connecting with all the vape shops in the world. Google: Germany Vape Shop Database
Vape Club are one of the UKâs leading online retailers of e-cigarettes, e-liquids, and other vaping accessories.
Founded and operated by a team of passionate vapers, Vape Club are proud to offer a virtually unmatched range specially tailored to the wider needs of the vaping community. From beginner kits to complex mods â everything you could ever need can be found here.
https://allvapestores.com/listing/unit-27-greenhill-crescent-watford-hertfordshire-wd18-8yb-vape-club/
Fresh from their recent success at a series of major UK award shows, Green Stem CBD has expanded their award-winning CBD enhanced range to include first-to-market CBD infused tonic waters free from sugar, artificial sweeteners and artificial flavourings.
Each can delivers 10mg of the highest quality broad-spectrum CBD and come in three delicious botanical flavours that include Elderflower, Rhubarb & Rose and Citrus. Recommended retail price is ÂŁ3.00 per can.
CBD â also known as cannabidiol â is renowned for its anti-inflammatory and antioxidant properties. Revered to promote harmonious balance between the mind and body it also supports with an array of conditions including anxiety and insomnia. Crucially, Green Stem CBD products are 100% free of THC, the psychoactive ingredient of cannabis, so they are entirely legal and safe to use.
The 250ml cans of tonic are adorned with the same beautiful artwork and design that have made Green Stem one of the most visible CBD companies in the UK and reflect the quality and purity of the ingredients in the can.
The tonic contains extracts of Quassia, a West Indian bitter wood which is known for its zesty flavour and health benefits. Added to the blend is Cinchona bark, one of the most important ingredients in tonic thanks to its high level of digestion-aiding quinine â with Green Stem being amongst the first to use botanically-infused quinine vs chemical extraction.
Manufactured at their HQ in Guildford, Surrey, the Green Stem CBD range is crafted using hemp oil rich in phytocannabinoids, derived from hemp grown organically in Colorado USA. All products are also thoroughly tested, enabling the proven health benefits of CBD to be experienced without any negative side effects.
Setting new standards in the industry, Green Stem CBD recently won a clutch of awards at the UK Hemp and CBD Show, winning Best CBD Oil at events in March and October in 2019.
âWe are delighted to have been recognised as one of the game-changers in the wellness industry this year with our award-winning CBD oils, inhalable and skincare products,â said Brett Horth, CEO of Green Stem CBD. âOur new venture into the edibles and drinks sector marks a hugely exciting stage in our journey, and we are certain that our customers will enjoy experiencing the benefits of CBD with these innovative new products.â
Read more at https://chillhempire.com/award-winning-green-stem-cbd-release-delectable-range-of-cbd-tonic-waters
Explode your wholesale sales with a click of a button. Google: Vitamins and Supplements Manufacturer, Wholesaler and Retailer B2B Marketing Data
Hello
My name is Sergey and I am a founder of Sweaty Quid Freelancer Market place where you can easily purchase and offer all types of online services ranging from back links and guest post to explainer videos, infographics and articles for your website.
I strongly believe that you and przeglad-urologiczny.pl can really benefit from Sweaty Quid, no matter if you wish to supply your services or employ the services of freelancers to assist you to expand your business.
I have been a freelancer on a number of marketplaces for in excess of 5 years and have had my accounts randomly shut down, my incomes pocketed and I simply had a tough time with lots of poor quality freelancers. After much disappointment, I decided to start up my very own freelance marketplace that would do things in a different way and a lot better.
After almost one year of caffeinne powered evenings, myself and my team at Creative Bear Tech have developed Sweaty Quid from ground up. One month into our launch we have managed to draw in a really good number of professional freelancers and an exceptionally high number of repeat customers. I believe this functions as a confirmation to our success.
Sweaty Quid is a spam-free and transparent marketplace for quality freelancers and buyers. We are rigorously banning all spammy vendors who do not pass our quality threshold and leave only the absolute best ones. Keeping abreast of the most recent technologcal changes, we also accept cryptocurrency as one of our payment methods. Our ethos that defines us is that sometimes less is more, particularly when it comes to quality freelancers.
We are still very new in contrast to other freelance market places, but we are already punching above our weight.
I would love to welcome you personally to join Sweaty Quid Freelancer Market Place!
Kind regards
Sergey Greenfields
Founder of Sweaty Quid Freelancer Marketplace
Flat 9, 1 Jardine Rd, St Katharine's & Wapping,
London E1W 3WD, United Kingdom
https://www.sweatyquid.com
Guaranteed SoloAd Mailer - 4000 Clicks/800 Leads - Sales Guaranteed
2020 SPECIAL: Get Double The Clicks On Any Solo Ad Purchased!
If you don't make sales then I keep re-running your Solo Ad until you get sales.
- 4000+ Unique Clicks Guaranteed
- 800+ Leads Guaranteed
- Detailed Email Click Tracking Included
- Solo Ad Starts Same Day Purchased
--------------------------------------------------------
Click Here For More Info ---> https://bit.ly/guaranteed-ads
--------------------------------------------------------
A Gift From Nature is a leader in the CBD industry. Located in Orlando, FL. A Gift From Nature has been formulating some of the highest quality CBD products in the market for the last three years. A Gift Form Nature is registered with the FDA and complies with good manufacturing practices. We currently produce 8 different brands with over 300 SKUs. We also provide raw material, White Label Services and Co packing. A Gift From Nature goes to great depths to source the highest quality natural ingredients for formulation. A Gift From Nature is really a seed-to-shelve company. All hemp extracts are sourced from extractors using American grown hemp. Every batch of extracts are vigorously third party tested for potency, terpenes, pesticides, bacteria, as well as residual solvents. A Gift From Nature believes in offering only the highest quality and cleanest products to our customers, so we solely rely on CO2 extraction, for its non-toxic characteristics.
https://lovetocbd.com/profile/billagfn
Yes! You read that right! We put our new magazine up on our website for FREE!
We made it 3D but you can also download it for free as a PDF and read it whenever you like, even without internet.
You can view it online or download it for free from here: https://www.dankdollz.com/3d-flip-book/dankdollz-magazine-issue-1/
We also have a few more advertising spaces left for our next issue. If you like what you see and would like to advertise your brand or range of products with us, get in touch with me below.
Look forward to hearing from you,
Tops Mohiuddin
Email: tops@dankdollz.com
www.DankDollz.com
Follow Us On Twitter - https://twitter.com/DankDollz
Follow Us On Instagram - https://www.instagram.com/dankdollz_mag/
Subscribe To Us On YouTube - https://www.youtube.com/channel/UCIG1d4Ci6nThd5vjIv__xRw
Hey
n95 masks directly from our factory in U.S.A.
We have large stocks.
Order here https://screenshot.photos/n95maskshopstock
Regards
"Sent from my Huawai phone"
Increase your B2B sales by connecting with all the vape shops in the world. Google: Global Hemp and CBD Shops Database with Contact Details
List przeglad-urologiczny.pl with a VAPE STORE DIRECTORY to increase your online exposure and sales. Simply Google "VAPE STORE DIRECTORY".
Vape Club are one of the UKâs leading online retailers of e-cigarettes, e-liquids, and other vaping accessories.
Founded and operated by a team of passionate vapers, Vape Club are proud to offer a virtually unmatched range specially tailored to the wider needs of the vaping community. From beginner kits to complex mods â everything you could ever need can be found here.
https://allvapestores.com/listing/unit-27-greenhill-crescent-watford-hertfordshire-wd18-8yb-vape-club/
Hello,
Our company makes handmade Large world globes that can be customized for your brand, company or interior design https://bit.ly/www-largeglobes-com
Please let me know if you would be interested in a custom large world globe and we can send more information.
Thank you.
Best regards,
Remus Gall
Globemaker at www.largeglobes.com
Project manager at Biodomes www.biodomes.eu
+40 721 448 830
Skype ID office@biodomes.eu
Str. Vonhaz nr 2/a Carei, Romania
-----------------------------
delete your site https://bit.ly/3eOn4NP
The analysis of the critical situation in the world may help Your business. We don't give advice on how to run it. We highlight key points from the flow of conflicting information. We call this situation: "Big Brother operation". Fact: pandemics; Agenda: control over the human population; Aim: reduction of the population; Who: a group of vested interests. Means: genetic engineering of viruses and vaccines; production of nanobots; mass-media communication satellites; big data; A.I.; global wi-fi. Ways: use and/or elaborate a pandemic carrier; mass media scares the population; load vaccines with nanobots; mandatory vaccination; control and direct humans. Thank You for the time of reading our unsolicited message! God bless You.
See https://bit.ly/evilempire-blog
See: https://www.amazon.com/s?k=fomenko+history+fiction+or+science&i=stripbooks-intl-ship&crid=20JCWH6NLWFHJ&qid=1589389931&sprefix=fomenko2C347&ref=sr_pg_1
Good afternoon, I was just taking a look at your website and submitted this message via your "contact us" form. The feedback page on your site sends you messages like this to your email account which is the reason you're reading through my message right now right? This is half the battle with any type of online ad, getting people to actually READ your advertisement and that's exactly what I just accomplished with you! If you have an advertisement you would like to blast out to millions of websites via their contact forms in the U.S. or anywhere in the world let me know, I can even target your required niches and my charges are very low. Reply here: Phungcorsi@gmail.com
TRIFECTA! A novel that starches your emotional â erotic itch!
Against a background of big business, deceit, frustration, oppression drives a wide range of emotions as three generations of women from the same family, turn to the same man for emotional support and physical gratification!
A wife deceives her husband while searching for her true sexuality!
What motivates the wifeâs mother and son-in-law to enter into a relationship?
The wifeâs collage age daughter, with tender guidance from her step-father, achieves fulfillment!
Does this describe a dysfunctional family? Or is this unspoken social issues of modern society?
BLOCKBUSTER Opening! A foursome of two pair of lesbians playing golf. A little hanky â panky, while searching for a lost ball out of bounds. Trifecta has more turns and twist than our intestines.
Trifecta! Combination of my personal experiences and creativity.
https://bit.ly/www-popejim-com for âCLICK & VIEWâ VIDEO. Send me your commits.
Available amazon, book retailers.
Trifecta! by James Pope
You Can DOUBLE Your Productivity For Life In Under 48 Hours
And when it comes to changing your life, there's nothing more important to fixing your productivity.
Think about it.
If you're twice as productive, then, as far as your environment supports it, you're going to make at least twice as much. However, the growth is almost always exponential. So expect even more income, free time, and the ability to decide what you want to do at any given moment.
Here's the best course I've seen on this subject:
https://bit.ly/michaeltips-com
It's a fun and pretty short read... and it has the potential to change your life in 48 hours from now.
Michael Hehn
Good morning, I was just taking a look at your website and filled out your contact form. The contact page on your site sends you these messages to your email account which is why you're reading through my message at this moment correct? This is the most important accomplishment with any type of online ad, making people actually READ your ad and this is exactly what you're doing now! If you have something you would like to blast out to lots of websites via their contact forms in the US or to any country worldwide send me a quick note now, I can even target specific niches and my charges are super low. Send a message to: cluffcathey@gmail.com
cease seeing these ads on your web contact page https://bit.ly/356b7P8
Hi
To confirm your seat at the Live webinar from Carol Bell & Michel de Bakker on Jun 9, 2020 02:00 PM in Eastern Time (US and Canada),
Send an email to confirmlivewebinarseat@gmail.com to reserve your seat.
What You Get on This live Webinar from Carol Bell & Michel de Bakker from MicaTech Coaching.
5 expensive mistakes many business owners make when doing their own marketing online...
How to know if you are targeting the wrong keywords...
What to do if you have no idea what you should be doing...
How to create a marketing plan and stop wasting time on things that donât work...
How to know if you are missing one of the most important components of your marketing ...
Regards
Carol Bell & Michel de Bakker
"Sent from my iPhone"
No more paying way too much money for overpriced Facebook advertising! I can show you a system that requires only a very small bit of cash and produces an almost indefinite volume of web visitors to your website
For more information just visit: https://bit.ly/adpostingfast
Want more visitors for your website? Receive thousands of people who are ready to buy sent directly to your website. Boost revenues fast. Start seeing results in as little as 48 hours. To get info Have a look at: https://bit.ly/traffic-for-you
Interested in the latest fitness , wellness, nutrition trends?
Check out my blog here: https://bit.ly/www-fitnessismystatussymbol-com
And my Instagram page @ziptofitness
Hello Admin,
YOU NEED QUALITY VISITORS for your: przeglad-urologiczny.pl
My name is Trinidad Lapine, and I'm a Web Traffic Specialist. I can get:
- visitors from search engines
- visitors from social media
- visitors from any country you want
- very low bounce rate & long visit duration
CLAIM YOUR 24 HOURS FREE TEST => https://bit.ly/3gqLEoE
Do not forget to read Review to convince you, is already being tested by many people who have trusted it !!
Przegląd Urologiczny - Pęcherz nadreaktywny i naglące nietrzymanie moczu - choroba jednostki czy choroba społeczeństwa. Etiologia i leczenie
ABOLISH REACTIVE DEPRESSION AND EMERGE FROM ITS DEEP, DARK, BLACK HOLE?
⢠Do you feel this came from the beginnings of a dysfunctional family system?
⢠Or did this come from the loss of a beloved job or loved one?
⢠Or did this come from dire effects from the disease of Alcoholism?
⢠Or did this come from the brainwashing attempts of a fearful and angry world, i.e. terroristic recruitment?
Do you know that whatever caused this DEEP, DARK, BLACK HOLE OF DEPRESSION which may have come from a NERVOUS BREAKDOWN can cease its influence over your life? Yes, you do not have to live buried in negative thinking from the defeat from negative life experiences in your life. Please know that any tragic experiences from childhood to adulthood need no longer affect your chance to gain emotional wellbeing.
Instead, now you have the opportunity to be HAPPY and in PEACEFUL CONTROL OF YOUR OWN DESTINY with only the memory of what once ailed you. Now is the time to overcome depression and begin to take control over your life. Not only that, you alone have the opportunity to reverse negative thinking and achieve your very own POSITIVE BELIEF SYSTEM.
PLEASE NOTE: Your views on spirituality or religion will not prevent you from successfully implementing your own PARENTAL SELF-LOVE PROCESS to ACHIEVE PURPOSE, MOTIVATION, GOOD SELF-ESTEEM, SUCCESS, AND MORE. Yes, like Lin Tillman did, you too can ACHIEVE MORE THAN YOU ASKED FOR and make meaningful and healthy contributions to this planet.
You can learn more about Linâs journey in her book The Invisible Girl & GOD, where she shares her TRUE STORY of how she healed herself from an agonizing depression with suicidal ideations.
GO TO: https://bit.ly/Depression-self-help to learn more
EROTICA becomes REALITY!!!
Stepping Stones to the ARCH De Pleasure
Men, put your feet in James Popeâs shoes, women put your feet in the womenâs shoes I encounter, as I traveled the road from farm-to-MATTRESONAME!
Stepping Stones is my third novel in a 3, connected, series. 1- Post Hole Digger! 2-Trifecta!
https://bit.ly/www-popejim-com âCLICK & VIEW videos. Search: amazon.com, title - author
YOU NEED FREE PROXIES ?
We provide great lists of free public proxy servers with different protocols to unblock contents,
bypass restrictions or surf anonymously.
Enjoy the unique features that only our page have on all the internet.
All proxies work at the moment the list is updated.
MORE INFO HERE=> https://bit.ly/2BiMfsJ
How would you like to promote your website for literally no cost? Check this out: https://bit.ly/zero-cost-ads
Stem cell therapy has proven itself to be one of the most effective treatments for Parkinson's Disease. IMC is the leader in stem cell therapies in Mexico. For more information on how we can treat Parkinson's Disease please visit:
https://bit.ly/parkinson-integramedicalcenter
TITLE: Are YOU Building Your Own DREAMS Or Has SOMEONE ELSE Hired You To Build THEIRS?Â
DESCRIPTION: Have you ever looked at sites like Google or Facebook and asked yourselfâŚâHow can they make SO MUCH MONEY when they arenât even really selling any products?!?!â
Well, Google and Facebook are cashing in on their platforms. Theyâre taking advantage of the millions of people who come to their sitesâŚThen view and click the ads on their pages.
Those sites have turned into billion dollar companies by getting paid to send traffic to businesses.
Did You Know That More People Have Become Millionaires In The Past Year Than Ever Before? Did You Know You Can Make Money By Becoming A Traffic Affiliate?
Watch Our Video & Discover The Easy 1-Step System Our Members Are Using To Get Paid Daily.
URL: https://bit.ly/retirement-biz
Hi
My package was damaged for the second time.
I made a photo so that you can see what I mean. https://imgurgallery.com/loh64aq
I hope you can help me solve this problem.
Sincerely
Franklyn Chambers
"Sent from my Android Phone"
Hello
I have received multiple emails from your marketing team enquiring about guest posting on Vape Life Mag.
Here are our guidelines: https://vapelifemag.com/feature-your-brand-or-vape-company-in-vape-life-mag/
We also charge a ÂŁ100 admin fee.
Regards
Vape Life Mag Editorial Team
The best SEO & Most Powerful link building software for your business.
I just checked out your website przeglad-urologiczny.pl and wanted to find out if you need help for SEO Link Building ?
If you aren't using SEO Software then you will know the amount of work load involved in creating accounts, confirming emails and submitting your contents to thousands of websites.
With THIS SOFTWARE the link submission process will be the easiest task and completely automated, you will be able to build unlimited number of links and increase traffic to your websites which will lead to a higher number of customers and much more sales for you.
IF YOU ARE INTERESTED, We offer you 7 days free trial => https://bit.ly/2ZPZrOn
Good morning, I was just on your website and submitted this message via your "contact us" form. The contact page on your site sends you these messages to your email account which is the reason you are reading through my message at this moment correct? This is the most important accomplishment with any kind of online ad, making people actually READ your message and I did that just now with you! If you have an advertisement you would like to blast out to thousands of websites via their contact forms in the U.S. or to any country worldwide let me know, I can even focus on particular niches and my prices are very low. Shoot me an email here: jessiesamir81@gmail.com
YOU NEED QUALITY VISITORS for your: przeglad-urologiczny.pl
My name is Arlie Burton, and I'm a Web Traffic Specialist. I can get:
- visitors from search engines
- visitors from social media
- visitors from any country you want
- very low bounce rate & long visit duration
CLAIM YOUR 24 HOURS FREE TEST => https://bit.ly/3h750yC
Stem cell therapy has proven itself to be one of the most effective treatments for COPD (Chronic Obstructive Pulmonary Disorder). IMC is the leader in stem cell therapies in Mexico. For more information on how we can treat COPD please visit:
https://bit.ly/copd-integramedicalcenter
Greetings, I was just taking a look at your website and filled out your contact form. The "contact us" page on your site sends you these messages to your email account which is why you're reading my message right now right? That's half the battle with any kind of online ad, making people actually READ your ad and this is exactly what you're doing now! If you have an ad message you would like to blast out to lots of websites via their contact forms in the US or to any country worldwide let me know, I can even focus on particular niches and my charges are super low. Shoot me an email here: destineylylazo75@gmail.com
I want off this list now https://bit.ly/3eOn4NP
Hello,
We are a great team from Palma de Mallorca (Spain) who are offering gorgeous holiday houses for rent, at special prices.
We offer large experience in the field- more than 15 years , high quality services, 24h assistance and speaking languages like Spanish, English and German.
This could be the vacation of your dream that is what you deserve this year, therefore you will find the best offers of absolutely beautiful villas in the island just visiting our website https://bit.ly/mysunshinetravel and feel free to contact us, via phone or email.
See you soon!
Have you had enough of expensive PPC advertising? Now you can post your ad on 10,000 ad websites and it'll cost you less than $40. Get unlimited traffic forever!
Check out our site now: https://bit.ly/continual-free-traffic
Would you be interested in an advertising service that costs less than $49 per month and delivers hundreds of people who are ready to buy directly to your website? Check out: https://bit.ly/buy-more-visitors
What measures do you have in place for your clients who don't qualify? The Credit Plug has a funded proposal for your lost/dead clients to get their credit back on track with the fastest turnaround in the industry and you gaining another loyal customer that potentially put $100 back into your business! https://bit.ly/kareemhenderson
This is a 15 year company with a great rating with the BBB.
You're 1 click away from discovering the"$100 per closed lead potential" available to your. The best part is you don't do the work, simply become an agent for the greatest financial gain or partner as a referral source instantly. Over the span of a lifetime, the average American will pay upwards of $1 million in extra expenses, because of a poor credit score... Don't Let this be your customers.
Want to monetize your dead leads?
https://bit.ly/kareemhenderson
How would you like to promote your website for absolutely no cost at all? Check this out: https://bit.ly/no-cost-ads
YOU NEED FAST PROXY SERVERS ?
Check it out this Anonymous and Private Proxy Servers.
HTTP & SOCKS5 Proxy supported.
IP Authentication or Password Authentication available.
HERE: https://bit.ly/3ifZkmL
YOU NEED FAST PROXY SERVERS ?
Check it out this Anonymous and Private Proxy Servers.
HTTP & SOCKS5 Proxy supported.
IP Authentication or Password Authentication available.
HERE: https://bit.ly/3ifZkmL
Hi, I was just taking a look at your website and filled out your "contact us" form. The contact page on your site sends you messages like this to your email account which is the reason you are reading through my message right now correct? That's half the battle with any type of online ad, making people actually READ your message and this is exactly what you're doing now! If you have an advertisement you would like to promote to millions of websites via their contact forms in the US or anywhere in the world send me a quick note now, I can even target particular niches and my charges are very affordable. Write an email to: denzeljax219@gmail.com
Hello
I hope this email finds you well.
I am the owner of a small boutique and we are now looking to expand our wholesale sales and conduct a guest post outreach for SEO.
I have come across your comment on this website immune-guard.us regarding CBT Yelp Website Scraper Software.
Would you recommend this software? I can see that many people have gotten good results but I thought I would ask you first-hand for my own peace of mind.
Thank you very much for your assistance.
I look forward to your response.
Kind regards
Dalary
Greetings, I was just on your website and submitted this message via your feedback form. The contact page on your site sends you these messages via email which is why you are reading my message at this moment right? That's the most important achievement with any kind of advertising, making people actually READ your ad and that's exactly what I just accomplished with you! If you have an advertisement you would like to promote to lots of websites via their contact forms in the US or to any country worldwide let me know, I can even target your required niches and my charges are very low. Send a message to: kinleytrey96@gmail.com
delete these messages from your website https://bit.ly/3cvHuJC
Quit paying 1000's of dollars for overpriced Google advertising! I can show you a method that charges only a very small bit of money and results in an almost endless volume of visitors to your website
Check out our site now: https://bit.ly/free-traffic-always
Greetings, I was just visiting your site and filled out your feedback form. The feedback page on your site sends you these messages via email which is why you're reading my message right now correct? That's the most important achievement with any type of online ad, getting people to actually READ your advertisement and this is exactly what you're doing now! If you have an ad message you would like to blast out to lots of websites via their contact forms in the U.S. or to any country worldwide send me a quick note now, I can even focus on specific niches and my charges are very low. Send a reply to: juniordannyqprj@gmail.com
stop receiving these messages on your website website contact form https://bit.ly/3eOn4NP
I WILL FIND POTENTIAL CUSTOMERS FOR YOU
Iâm talking about a better promotion method than all that exists on the market right now, even better than email marketing.
Just like you received this message from me, this is exactly how you can promote your business or product.
CLAIM YOUR TEST PERIOD => https://bit.ly/3hdwfaC
Learn how to create fast loading landing pages at no cost. Unlimited hosting and bandwidth for free here ==> https://zeep.ly/wFAfp
Good afternoon, I was just taking a look at your website and filled out your "contact us" form. The contact page on your site sends you these messages via email which is why you are reading my message at this moment correct? That's the most important accomplishment with any type of online ad, getting people to actually READ your ad and this is exactly what you're doing now! If you have something you would like to blast out to tons of websites via their contact forms in the U.S. or to any country worldwide let me know, I can even target specific niches and my costs are very reasonable. Send a message to: danielsamson9146@gmail.com
Hi, I was just taking a look at your site and filled out your feedback form. The "contact us" page on your site sends you messages like this via email which is why you are reading my message at this moment right? That's half the battle with any kind of online ad, getting people to actually READ your advertisement and that's exactly what I just accomplished with you! If you have an ad message you would like to promote to lots of websites via their contact forms in the US or anywhere in the world send me a quick note now, I can even target particular niches and my charges are super reasonable. Send a message to: lorenzodaniel9137@gmail.com
unsubscribe me https://bit.ly/3eTzNib
Hi, Iâm Jarred, Callanan
I am contacting you on behalf of Natural Apiary.
Natural Apiary is offering an affiliate program that allows you to create links and earn referral fees when customer clicks through and buy products.
Itâs completely free to join and easy to use.
Give your websites visitors the ease of referring them to a trusted site where they can purchase products you advertise.
And when they do, you can earn up to 17% of their total purchase.
Take advantage of Natural Apiary retail promotions and drive traffic and earn commissions.
Click here: https://zeep.ly/hdWF7
Kind Regards,
YOU NEED FAST PROXY SERVERS ?
Check it out this Anonymous and Private Proxy Servers.
HTTP & SOCKS5 Proxy supported.
IP Authentication or Password Authentication available.
HERE: https://bit.ly/3ifZkmL
Hi, I was just on your website and filled out your feedback form. The "contact us" page on your site sends you these messages via email which is the reason you're reading through my message right now right? That's half the battle with any type of advertising, making people actually READ your ad and that's exactly what I just accomplished with you! If you have something you would like to blast out to millions of websites via their contact forms in the U.S. or to any country worldwide send me a quick note now, I can even target your required niches and my prices are very low. Write an email to: danielsamson9146@gmail.com
YOU NEED QUALITY VISITORS FOR YOUR: przeglad-urologiczny.pl
WE PROVIDE ORGANIC TRAFFIC BY KEYWORD FROM SEARCH ENGINES OR SOCIAL MEDIA
YOU GET HIGH-QUALITY VISITORS
- visitors from search engines
- visitors from social media
- visitors from any country you want
CLAIM YOUR 24 HOURS FREE TEST => https://bit.ly/2HQZggh
YOU NEED QUALITY VISITORS FOR YOUR: przeglad-urologiczny.pl
WE PROVIDE ORGANIC VISITORS BY KEYWORD FROM SEARCH ENGINES OR SOCIAL MEDIA
YOU GET HIGH-QUALITY VISITORS
- visitors from search engines
- visitors from social media
- visitors from any country you want
CLAIM YOUR 24 HOURS FREE TEST => https://bit.ly/2HQZggh
SPECIAL PRICE OFFER
GENUINE PARTS BMW, MERCEDES, PORSCHE & VAG
December 2020
Up to 50% off Bulk sale through December
Dear Sirs,
Please check our December Special Price offer for the genuine auto part from Germany
All prices are in euros.
Delivery time 14-21 days.
validity period of special prices until 25.12.20
Download Price Lists: https://firsturl.de/1H7nwoy
We apologize in advance if our offer did not interest you and/or it caused inconvenience.
NOT SATISFIED WITH YOUR HOSTING ?
Check Out Our Coupons for This Month & Get Your Domain, Hosting and SSLs For Less!
Namecheap Offers Amazing Deals That Save You Money Across Our Product Range!
Best Value Web Products. 20 Years Serving You. Free WhoisGuard. #1 for Value Vs. Others.
Check Out Our Coupons for This Month => https://zeep.ly/5uSUK
NOT SATISFIED WITH YOUR HOSTING ?
Check Out Our Coupons for This Month & Get Your Domain, Hosting and SSLs For Less!
Namecheap Offers Amazing Deals That Save You Money Across Our Product Range!
Best Value Web Products. 20 Years Serving You. Free WhoisGuard. #1 for Value Vs. Others.
Check Out Our Coupons for This Month => https://zeep.ly/5uSUK
Would you like no charge advertising for your website? Check out: https://bit.ly/free-ads-forever
NOT SATISFIED WITH YOUR HOSTING ?
Check Out Our Coupons for This Month & Get Your Domain, Hosting and SSLs For Less!
Namecheap Offers Amazing Deals That Save You Money Across Our Product Range!
Best Value Web Products. 20 Years Serving You. Free WhoisGuard. #1 for Value Vs. Others.
Check Out Our Coupons for This Month => https://zeep.ly/5uSUK
Want free traffic? Let me show you five high traffic sites where you can promote your website completely free: https://bit.ly/free-traffic-and-sales
Get traffic for your online business, local shop/service or blog for totally free. This post will show you 5 cool ways to get free unlimited ads for your business: https://bit.ly/5waystoadvertisefree
Interested in an advertising service that charges less than $50 every month and sends thousands of people who are ready to buy directly to your website? Check out: https://bit.ly/buy_keyword_targeted_visitors
Hello
YOU NEED HELP FOR SEO LINK BUILDING?
I just checked out your website przeglad-urologiczny.pl, and wanted to find out if you need help for SEO Link Building ?
We offer you the BEST SEO STRATEGY for 2021, my name is Summer, and I'm a SEO Specialist.
Build unlimited number of Backlinks and increase Traffic to your websites which will lead to a higher number of customers and much more sales for you.
If You Are Interested, I'm waiting for your response here => https://bit.ly/32uQKuH
Thanks,
SEO Specialist
Good Day
I have just analyzed domain: przeglad-urologiczny.pl for the current search visibility and saw that your website could use a push.
We will increase your SEO metrics and ranks organically and safely, using only whitehat methods, while providing monthly reports and outstanding support.
Please check our plans here, we offer SEO at cheap rates.
https://speed-seo.net/product/monthly-seo-package/
Start improving your sales and leads with us, today!
regards
Mike Gist
Speed SEO Digital Team
support@speed-seo.net
Hello, I was just taking a look at your site and submitted this message via your "contact us" form. The "contact us" page on your site sends you messages like this to your email account which is the reason you are reading through my message right now correct? This is the most important achievement with any kind of online ad, getting people to actually READ your advertisement and that's exactly what I just accomplished with you! If you have an ad message you would like to promote to lots of websites via their contact forms in the US or anywhere in the world send me a quick note now, I can even focus on your required niches and my charges are super reasonable. Reply here: ZionShaffer31294x@gmail.com
Hello
YOU NEED QUALITY VISITORS FOR YOUR: przeglad-urologiczny.pl ?
WE PROVIDE HIGH-QUALITY VISITORS WITH:
- 100% safe for your site
- real visitors with unique IPs. No bots, proxies, or datacenters
- visitors from Search Engine (by keyword)
- visitors from Social Media Sites (referrals)
- visitors from any country you want (USA/UK/CA/EUâŚ)
- very low bounce rate
- very long visit duration
- multiple pages visited
- tractable in google analytics
- custom URL tracking provided
- boost ranking in SERP, SEO, profit from CPM
CLAIM YOUR 24 HOURS FREE TEST HERE=> ventfara@mail.com
Thanks, Rudolph Winchester
Wanna post your business on 1000's of Advertising sites every month? For a small monthly payment you can get almost endless traffic to your site forever!
To find out more check out our site here: https://bit.ly/zero-payment-traffic
Find out how you can promote your site without paying anything at all!
Have a look at this amazing list consisting of the most popular directory websites now >https://bit.ly/list-0f-free-ad-sites
Hello
YOU NEED FAST PROXY SERVERS ?
Check it out this Anonymous and Private Proxy Servers.
- HTTP & SOCKS5 Proxy supported.
- IP Authentication or Password Authentication available.
- MORE INFO HERE: https://bit.ly/3ifZkmL
Thanks, Bess Gibney
If you no longer wish to hear from us, please reply this email.
Ever tried to create Voice-overs for your videos? Youâve likely discovered: í ˝íąFreelance Voice-over Artists are expensive í ˝íą It can take days for them to deliver í ˝íąâText To Speechâ sounds like a lifeless Robot - not anymore!. Listen to a demo now. Just reply to this email: katesepage@gmail.com
Hello
YOU NEED HELP TO BUILD SEO LINKS FOR: przeglad-urologiczny.pl ?
I just checked out your website, and wanted to find out if you need help for SEO Link Building ?
WE OFFER YOU THE BEST SEO STRATEGY FOR 2021.
Build an unlimited number of Backlinks and increase Traffic to your websites which will lead to a higher number of customers and much more sales for you.
If You Are Interested, I'm waiting for your response here => seosubmitter@mail.com
Thanks, Louisa McDonald
Hello
YOU NEED QUALITY VISITORS FOR YOUR: przeglad-urologiczny.pl ?
WE PROVIDE HIGH-QUALITY VISITORS WITH:
- 100% safe for your site
- real visitors with unique IPs. No bots, proxies, or datacenters
- visitors from Search Engine (by keyword)
- visitors from Social Media Sites (referrals)
- visitors from any country you want (USA/UK/CA/EUâŚ)
- very low bounce rate
- very long visit duration
- multiple pages visited
- tractable in google analytics
- custom URL tracking provided
- boost ranking in SERP, SEO, profit from CPM
CLAIM YOUR 24 HOURS FREE TEST HERE=> ventfara@mail.com
Thanks, Eugenia Walton
Itâs tough to discover professional people in this distinct topic, however, you seem such as you know what youâre referring to! Thanks
Hey,
My name is Tyler and I work with Challenger social. We work with businesses like yours przeglad-urologiczny.pl to help you rank first on google, increase leads and reduce your marketing budget while improving results with optimized ad-words and SEO - meaning that you only spend money on marketing that gets you results.
For instance, we helped multiple clients & trusted companies increase their online leads by 102% while also cutting the cost of each lead in half. Helping them to increase their market share and profit. (Link to case studies - https://bit.ly/3z1sCPg)
Iâd love to help do the same for you!
Do you mind if I send over a few times for a quick call to see if it's a good fit?
Excited!
Thanks,
Tyler
Hello
YOU NEED QUALITY VISITORS FOR YOUR: przeglad-urologiczny.pl ?
We Provide Website Traffic 100% safe for your site, from Search Engines or Social Media Sites from any country you want.
With this traffic, you can boost ranking in SERP, SEO, profit from CPM
CLAIM YOUR 24 HOURS FREE TEST HERE=> ventfara@mail.com
Thanks, Ambrose Witmer
Hello
YOU NEED QUALITY VISITORS FOR YOUR: przeglad-urologiczny.pl ?
We Provide Website Traffic 100% safe for your site, from Search Engines or Social Media Sites from any country you want.
With this traffic, you can boost ranking in SERP, SEO, profit from CPM
CLAIM YOUR 24 HOURS FREE TEST HERE=> ventfara@mail.com
Thanks, Mariel Dunhill
You won't believe how easy it is to get free advertising on Google. Here's 20 Clever Ways to Get Free Advertising on Google & Beyond: https://bit.ly/how-to-get-free-advertising-on-google
Hello
YOU NEED HELP TO BUILD SEO BACKLINKS FOR: przeglad-urologiczny.pl ?
WE SELL HIGH-QUALITY DOFOLLOW POWERFUL BACKLINKS WITH HIGH DOMAIN AUTHORITY, PA, TF, CF...
âş Rank Higher In Google (google backlinks, DoFollow backlinks, SEO DoFollow backlinks)
âş Rank Higher Video in Youtube & Google (youtube backlinks, video backlinks, video embedded)
âş Rank Higher GMB In Google Maps (Google maps backlinks, GMB maps backlinks, GMB embedded, NAP embedded)
âş Rank Higher Images In Google (google images backlinks, google backlinks)
You Can Increase Traffic to your websites which will lead to a higher number of customers and much more sales for you.
CLAIM YOUR FREE TEST HERE => seosubmitter@mail.com
Thanks, Sophia Estes
Hello
YOU NEED HELP TO BUILD SEO BACKLINKS FOR: przeglad-urologiczny.pl ?
WE SELL HIGH-QUALITY DOFOLLOW POWERFUL BACKLINKS WITH HIGH DOMAIN AUTHORITY, PA, TF, CF...
âş Rank Higher In Google (google backlinks, DoFollow backlinks, SEO DoFollow backlinks)
âş Rank Higher Video in Youtube & Google (youtube backlinks, video backlinks, video embedded)
âş Rank Higher GMB In Google Maps (Google maps backlinks, GMB maps backlinks, GMB embedded, NAP embedded)
âş Rank Higher Images In Google (google images backlinks, google backlinks)
You Can Increase Traffic to your websites which will lead to a higher number of customers and much more sales for you.
CLAIM YOUR FREE TEST HERE => seosubmitter@mail.com
Thanks, Julie Anthony
Do you want more visits to your przeglad-urologiczny.pl ?
I succeeded and it works with this Fiverr gig https://zeep.ly/RgLhL
New method to advertise doesn't involve any costs at all: https://bit.ly/no-more-ad-costs
This new method allows you to advertise for free on sites like Google. Find out more here: https://bit.ly/20-ways-to-get-free-ads
Ads that charge for clicks only make the ad companies rich. Here's a more common sense approach: https://bit.ly/no-more-ppc-costs-ever
Why pay for ads when you can get them free? Here are 50 proven ways to get effective advertising for your site : https://bit.ly/how-to-get-free-advertising
Effective And Free Ways To Advertise. Here Is A List... : https://bit.ly/free-ads-resource
U fucking pedophile - sick fuck
https://cbdfx.com/privacy-policy/
Since everyone needs traffic to their websites, Google, YouTube, Facebook, and LinkedIn are among the top 20 most visited sites in the world. There are so many other sites that you can get traffic to your site from that most marketers havenât even considered. Here are 5 examples of high traffic sites that you can take advantage of and drive tons of free traffic back to your site.https://shortest.link/G2M
A maverick Japanese doctor recently leaked the secret ingredients of an ancient Japanese Tonic that targets the root cause of deep belly fat and activates a powerful little-known fat-burning hormone inside youâŚthat MELTS away all your stubborn body fat.
=> Discover the âDone for Youâ Japanese Tonic to Melt 3 Pounds Every 3.5 Days
==>https://1mdr.short.gy/hLNWVS
Hi
I have a question, i see a lot of products in this store that you also sell in your store, But there items are 59% cheaper, i have made a screenshot of the product, so you can see for your self. https://screenshot-product.photo/4702.
Well my question is what is the difference between your shop.
Is it the quality or something else, i hope you can help me!
Regards
Jesenia Vandiver
"Sent from my iPhone"
How to earn extra cash with your website without doing a thing: https://tinyurl.com/ye5kbkbh
When you hear the word advertising, paid methods most likely come to mind. Pay-per-click ads, affiliate marketing, hiring an SEO professional, and so on. It might surprise you to hear that not all methods of advertisement cost money â not even on Google. Here are 20 Clever Ways to Get Free Advertising on Google & Beyond: https://ai6.net/0zWOmq
7 Ways To Promote Your Business Online For Free : https://urlday.cc/glfql
Paid ads are a waste of money these days, clicks cost a fortune and you can never seem to get enough of them to justify the expense. This is why I have compiled this list of 20 ways you can advertise for free on sites like Google. Now I want to share it with the world. Click here to go ahead and view the PDF now: https://cutt.ly/DQ6IWkM
With over 3.5 billion searches per day, Google is a hotspot for consumers. And with its location-specific and rich results, it is ingrained in our daily lives as the go-to tool for, well, anything â getting the weather, buying tickets, finding products, vetting services, answering quick questions, seeing if a local store is open, and the list goes on. Here are some strategies your local business can implement to get on this highly trafficked search engine for free. https://ai6.net/d2H9hP
Everything is quite open with a extremely obvious clarification of the problems. It was unquestionably enlightening. Your site is rather beneficial. Quite a few thanks for sharing!
Imagine being able to upload a simple video
to YouTube and start generating traffic & sales
MINUTES later. You'll be able to dominate Page 1 of both
Google & YouTube without creating a single backlink!
Check it out: https://1mdr.short.gy/PhTe6f
Now you can get thousands of high quality niche targeted website visitors for less than the price of a few clicks on Google. Find out more here: https://shortest.link/IE4
There's not need to ever pay for clicks for your ad campaigns again. With this free system you'll leverage free highly effective sources instantly! https://cutt.ly/zWaxj3a
How To Advertise Online Without Paying A Dime :https://cutt.ly/FWkMCp5
This web traffic costs one tenth to 1/100th the cost of Google Adwords and is high quality and targeted specifically for your keywords: https://is.gd/ofgolP
You nead Search engine advertising - Google AdWords campaigns from the expert team ONMA scout ?
GOOGLE AD TIPS THAT MAKE YOU MORE MONEY.
A properly implemented PPC campaign is vital for an advertiser to work for their conversions and profits.
SEE HERE https://zeep.ly/FSuqG
If you've ever wondered how top companies leverage popular advertising platforms to get their ads for free then you need to read this article that shows 50 different ways how to do it: https://shortest.link/1cG5
You nead Search engine advertising - Google AdWords campaigns from the expert team ONMA scout ?
GOOGLE AD TIPS THAT MAKE YOU MORE MONEY.
A properly implemented PPC campaign is vital for an advertiser to work for their conversions and profits.
SEE HERE https://zeep.ly/FSuqG
Did you know that there are hundreds of sites where you can advertise your website for free? Here's a list of some of them: https://urlday.cc/bpz88
You nead Search engine advertising - Google AdWords campaigns from the expert team ONMA scout ?
GOOGLE AD TIPS THAT MAKE YOU MORE MONEY.
A properly implemented PPC campaign is vital for an advertiser to work for their conversions and profits.
SEE HERE https://zeep.ly/FSuqG
Hey
I have a question, i see a lot of items in a shop that you also sell in your shop, But there items are 46% cheaper, i have made a screenshot of the item, so you can see for your self. https://screenshot-product.photo/2346.
Well my question is what is the difference between your shop.
Is it the quality or something else, i hope you can help me!
greetings
Issac Ledbetter
"Sent from my iPhone"
Want to improve your website's look and feel for free? Check out some of these free wordpress plugins: https://cutt.ly/nRdeCLH
Get free backlinks on sites that Google loves! Here's where you can get them: https://bit.ly/backlinks-for-free2
Who says you have to pay for web traffic? Here are a bunch of high traffic sites that take free ads: https://urlday.cc/bpz88
Hi There!
We are reaching out to those from the math education space who would be excited to participate in our FREE Virtual Summit coming up on November 13th and 14th, 2021.
Not only will you love hearing 25+ influencers from the math education space presenting live over Zoom, but I'm sure your audience and colleagues will stand to benefit as well!
Register to save your seat here: https://zeep.ly/GwPnv
Will we see you there?
Kyle & Jon
admin@makemathmoments.com
https://zeep.ly/GwPnv
PS - Consider sharing this amazing free event with others in the education space!
Hi,
My name is Tyrell and I recently worked on a website similar to przeglad-urologiczny.pl.
Quick question, Would you be interested in having me generate sales calls with your ideal prospects on a Pay-Per-Call basis?
Here is a quick video explaining how I generate hundreds of calls each month for my current clients www.challengersocial.ca.
Best,
Tyrell
Automatic ad submitter - get continuous traffic from thousands of ads. Post your site now: https://goolnk.com/0rmWvG
Is there an actual person I can talk to?
Hi, can you please tell me if you're still offering the $50 discount like I saw on www.shinynewad.xyz?
I was wondering if you're looking to get more sales? I can get people to come to your site who have been pre-qualified specifically for your niche and are most likely to buy. See www.generatemoresales.xyz
Submit your site to over 35 advertising websites for free now https://bit.ly/submityourwebsite
Free submission of your new website to over 35 business directories here https://bit.ly/addyoursitehere
Free submission of your new website to over 35 business directories here https://bit.ly/addyoursitehere
Submit your site to our 30 directories all with one click here> https://bit.ly/addyoursitehere
YOU NEED REAL VISITORS FOR: przeglad-urologiczny.pl ?
We Provide 100% Real Visitors To Your Website.
With this traffic, you can boost ranking in SERP, SEO, profit from CPM...
CLAIM YOUR 24 HOURS FREE TEST HERE=> https://zeep.ly/ka3Ur?10179
Add your site to all 35 of our business directories with one click here-> https://bit.ly/addyoursitehere
You are looking for Free Backlinks then you came to the right place.
We offering you a free trial to try out our link-building service.
This can be used to link out to your website, inner page, google map, video, to any link you want to help power up and get more relevance too.
We want to prove to you that our backlinks work and so weâre willing to prove it to you risk-free.
Please create an account and then watch the video and submit your order details and let us help you get found online.
FREE TEST HERE: https://zeep.ly/6SDFB
Hello,
Iâve been an reader of your blog for some time now, and I enjoy reading your blog on a regular basis.
Recently Iâve been researching an idea for a blog post about human hair wigs â and then I thought that this could be a great contribution for your audience.
Iâll make sure the piece overflows with information that canât be found anywhere else.
What do you think? Should I write it up and send you a draft?
Here are some topics you maybe interested:
[What are the different types of human hair wigs?]
[What do I need to know about human hair wigs?]
[What is the best human hair wig?]
I look forward to hearing from you soon.
Best,
Newigstyle Team
Hello,
I hope Iâm not bothering you, my name is Tylerl and I see that you own przeglad-urologiczny.pl. I noticed a few errors on your website that could be causing you to lose some traffic & customers.
Do you have 5 minutes to speak about this?
Hope to talk soon!
Tyler
Hi buddy!
Recently I found your website while reading bunch of websites. After checking, I noticed that you did not monetize you website well. It's okay, I just want to share my method to earn $25 - $30 per hour using simple tricks.
If you interested what method I use, you can try check my method here: https://milesia.id/EarnMoneyFromSocialMedia
Hope you start earning money as soon as possible.
Have a nice day!
Milesia
Are you still in business? I used a tool to check your website and saw some major issues. You can check yourself right now for free with https://shineranker.com/
Hello,
przeglad-urologiczny.pl gets a fair amount of traffic, have you ever considered automating the process of turning that traffic into new customers?
I ask because my area of expertise is helping businesses acquire new customers at a profit without spending money on advertising.
Would you be interested in learning more if I could show you how I could get you 15-40 new customers beginning next week without any additional advertising costs or extra effort form you/staff?
If youâre the slightest bit curious, just let me know if it sounds like something youâd be interested in having a quick chat about.
Best,
Ty
Hello
Are you new to SEO and want to rank #1 on google this upcoming year?
Here are 3 SEO strategies that will boost your rankings!
#1: Focus on content
#2: Optimize your title tag and your meta description
#3: Use Google Search Console
Subscribe here to learn more of my
Secret SEO Tips & Trics https://zeep.ly/WkJgE?=499
Thanks,
Wilburn Dominique
Please do not reply directly to this email!
Excellent. Hi, I'm Martin from MediaPlan.
If you have capacity for more Clients/Customers/Patients we can help.
Check this 3 minute video and let us know if this suits your Media Plan for business growth.
https://mediaplan.clientcabin.com/
Regards
Martin
MediaPlan
Thanks
Horny Shriya called you 2 times. She is online. Click the below link to chat with her. She is very horny now.
https://live-sex-chat.club/?call=horny-shriya
22Thanks585
xxbunadiminacumzsertyy
bunadi2222222minacumzsert
Hey,
Just came across this cyber security company that
helps you protect your website from cyber attacks
and hackers. Hopefully you can benefit from the info.
Check it out and see what you think...
BestWebsiteProtection.com
Have a Great day!
Marcus Anthony
Hi my name is Mike, I noticed that your business is under performing. If you do not take action you will fall behind the competition during this recession.
Jasperwrite.com
Regards,
Mike
Email:optout@jasperwrite.com
Hello there,
Popup notifications are a fast and efficient way to communicate with your audience, they can help you send real-time updates and reminders that get your audience to regularly engage with your brand.
Sales Proof Social allows you to keep in touch with your users by providing timely messages, a preview of suggested products, special offers, Customer activity notifications, and customer reviews.
Start for free by clicking on the link below!
https://app.salesproof.social/
Best,
Dave
E: hello@cuboidmarketing.com
W: https://app.salesproof.social/
Hello. My name is Nick, I am an entrepreneur and creator of the revolutionary software www.nick-ai.ca.Which will help your business in writing any content in seconds and attract more customers.
Ten years ago I created my first business and for ten years I had the pain of writing content. I was thinking about how to make it possible to write any content in seconds, for advertising, social media posts, emails to friends, business partners, clients, blogs, create engaging content for my videos, respond to customer reviews, write reviews, and write absolutely any content in seconds. Working on this project for several years we have created artificial intelligence software that can do all of the above in seconds.
I want to give you free access for seven days to Nick-ai.com please give me feedback on how much you like what we do.
Thank you Nick Founder of Nick AI.
My email adress - nickairevolution@gmail.com
My Website NICK-AI.CA
Did you know that you could use this super powerful All In One tool that makes it fast & super easy to create an IMMEDIATELY profitable online business? this powerful All In One system can help you get profits in less than 24 hours, in a few simple clicks... It gets even better: You can do all this Without Ever Creating Your Own Products, or Websites, and Even if you are a complete beginnerââ.
Go Here For Immediate Access: brilliantmoneyhacks.com
Regards
Did you know that you can use this very simple All In One system that makes it fast & easy to own an IMMEDIATELY profitable online business? this simple All-In-One business model can help you get results in around 24 hours, in a few clicks... Thatâs not all: You can do all this Without Ever Creating Your Own Product, or Websites, and Even if you are a complete beginnerââ.
Learn More Here : brilliantmoneyhacks.com
Kind regards
Submit your site to over 1000 directories all with one click here> https://bit.ly/submit_site_2
I was wondering if you wanted to submit your new site to our free business directory? https://bit.ly/submit_site_1
Looking for more website visitors? We'll get things moving for you! Take a look : bit.ly/targeted-traffic-for-your-site
Good job on the new site! Now go ahead and submit it to our free directory here https://bit.ly/submit_site_9jxc1c6t8mpn
Hello. My name is Nick, I am an entrepreneur and creator of the revolutionary software www.nick-ai.ca.Which will help your business in writing any content in seconds and attract more customers.
Ten years ago I created my first business and for ten years I had the pain of writing content. I was thinking about how to make it possible to write any content in seconds, for advertising, social media posts, emails to friends, business partners, clients, blogs, create engaging content for my videos, respond to customer reviews, write reviews, and write absolutely any content in seconds. Working on this project for several years we have created artificial intelligence software that can do all of the above in seconds.
I want to give you free access for seven days to Nick-ai.com please give me feedback on how much you like what we do.
Thank you Nick Founder of Nick AI.
My email adress - nickairevolution@gmail.com
My Website NICK-AI.CA
Add your site to 1000 business directories with one click here-> bit.ly/submit_site_4lSEZtY470R0
Want to test drive this smart Magic Link that makes it super fast & super easy to attract an avalanche of free traffic for your website przeglad-urologiczny.pl? This smart Magic Link sends thousands of targeted leads, FOR YOU, on autopilot every single day....
Want to learn How To Get Your First 2,000 Buyers for FREE, & Scale Your Business Faster Than Ever? That's how many leads you'd get on your site, within 1 day of starting to use this powerful hack.
Your Access Here : lazytraffic.com
Check out how easy it is, how fast you can receive thousands of visitors per day & how you'll be making passive income without touching a a thing.
Our business stopped spending so much time & money on paid ads... We let the Magic Link produce sales for us. Now, imagine for a second, never having to run a single ad, ever again, for the rest of your life. Thatâs what this Magic Link will do for you.
Your Access Here: lazytraffic.com
Regards
P.S: The creators of this Magic Link consulted with the worldâs smartest traffic generation and Direct Response Marketing gurus to teach the tool how to find potential leads, for you.
Your business is seriously missing out right now by not using itâŚ
Hi ,
Unlock the Tiktok marketing success secrets
click here :https://tiktoksecrets.gr8.com/
Unlock the seceret to a self writing bot that uses Artificial Inteligence and has the power of every search engine behind it. Join this class to teach you what it is all about and how to utilize it in your business! Check out the class here https://CHATGPTRiches.AI
Hey!
And itâs LIVE!
Recurring Commission System has officially opened to the public!
>>> https://www.xoxourl.com/reccomm
Recurring Commission System is the 1st and ONLY software solution that makes it easy for ANYONE to bank multiple income streams and build their list at the same time!
This cloud based app provides you with your very own stunning site that includes a professional video & details showing visitors what they need to know about essential web tools ...
With links that get you paid recurring commissions from up to 18 different services.
It also directs visitors to optin for a free training webinar ⌠where you make $1000 from EVERY purchase.
Just grab THIS to take home the BIG paydays!
>>> https://www.xoxourl.com/reccomm
Hereâs what you get:
DFY, PROFESSIONAL website optimized for recurring, passive AND high ticket commissions
MULTIPLE income streams: youâre pre-approved to profit from the 18 recurring services AND high-ticket offer built into your site
Free viral traffic & hosting included = ZERO overhead costs
Set & forget method: customize your site ONCE, then it runs on 100% autopilot
Completely beginner friendly: no tech skills needed, nothing to install, step-by-step instructions included
Easy to scale: Recurring Commission System INCLUDES the core software so you can customize this system to fit ANY offer
Enjoy!
Hey!
Are You Ready To Use Instagram âStoriesâ Get Huge Followers, Traffic, And Make Unlimited Sales On Autopilot?
If Your Answer Is "YES"
Please Click here: https://bit.ly/instagramstries
Cheers
Claim your $500 Google Ad Credit + FREE 7 Day Trial
https://www.xoxourl.com/adcreativeAI
Unlock the true potential of your Marketing Agency.
Marketing agencies: Wouldnât it be nice if those Ad Creatives justâŚcreated themselves?
... WITHOUT outsourcing to an EXPENSIVE graphic designer?
Brand NEW AI generates winning creatives in no time flat at an unbeatable price.
Use the power of AI to win the hearts and wallets of your clientâs audiences.
Claim a $500 Google Ad Credit + FREE 7-day trial now -> https://www.xoxourl.com/adcreativeAI
Cheers!!!
Whatever your plans for today were, they just changed.
Nine new deals just entered the store. You read right, nine!
Clear out your schedule and kick this week off right with tools to effortlessly create apps, produce grade-A video content at scale, and more.
ALTI TRADING
Expert training and tools to develop smart trading strategies.
Lifetime access to ALTI TRADING: https://www.xoxourl.com/antitraining
Andromo
Build iOS and Android apps the easy way.
Lifetime access to Andromo: https://www.xoxourl.com/andromo
BHuman
Generate and share personalized videos with thousands.
Lifetime access to BHuman: https://www.xoxourl.com/bhuman
Dashly
Convert high-quality leads with enticing chatbots, pop-ups, and email outreach.
Lifetime access to Dashly: https://www.xoxourl.com/dashly
Directual
Launch no-code apps for web and web3.
Lifetime access to Directual: https://www.xoxourl.com/directual
Feederloop
Create an incredible customer service experience with instant video chat on your site.
Lifetime access to Feederloop: https://www.xoxourl.com/feederloop
Gravitec
Send automated push notifications to skyrocket user engagement.
Lifetime access to Gravitec: https://www.xoxourl.com/gravitec
Pipio
Use photorealistic digital actors and voice-over talent to create custom videos.
Lifetime access to Pipio: https://www.xoxourl.com/pipio
ZeroWork Creator App
Build automations then sell them in a dedicated marketplace.
Lifetime access to ZeroWork Creator App: https://www.xoxourl.com/zerowork
Cheers
Hi i see that you do a lot of SEO for yourself and your clients, here is a great new software that takes all the guess work out,
https://ShineRanker.harveysmarketing.net
thanks
Harvey
Hi,
Do you run Social Media Marketing Campaigns or Email Marketing Campaigns for your Business?
The 1st and ONLY Autoresponder That Combines REAL Artificial Intelligence WITH The POWER of Email, Text, and Facebook Messenger Marketing Under ONE Central Dashboard - with ZERO Monthly Fees!
https://bit.ly/automation30
What's Included:
âş Facebook Automation
âş Twitter Automation
âş Email Marketing Automation
âş SMS / Mobile Marketing Automation
What else would you need if you can automate your blog / business marketing with Automation ?
Either you are running a business or a website - This will be a Lifechanging One Time Deal (No Monthly Payments for Early Adopters).
Grab this Deal: https://bit.ly/automation30
(Launch DAY Special Discount Applied)
Cheers
Hi i see that you do a lot of SEO for yourself and your clients, here is a great new software that takes all the guess work out,
https://ShineRanker.harveysmarketing.net
thanks
Harvey
Hi i see that you do a lot of SEO for yourself and your clients, here is a great new software that takes all the guess work out,
https://ShineRanker.harveysmarketing.net
thanks
Harvey
Any Text to Audio in 1 Click.
No Language Boundries: Easy Text to Speech in English, Hindi, Spanish, German, Arabic and 100+ other Languages in Native Human sounding voices.
Either you make videos for YouTube, Facebook, Instagram, Twitter, Tiktok on profile Channel of Business profile.
No more Spending Hard Earnead Cash on expensive Voice Over Artists.
Grab this Limited Time 1 Time Payment Deal i.e. No More Monthly Payments.
Click here >>> https://bit.ly/ttoaudios
Cheers
Hi i see that you do a lot of SEO for yourself and your clients, here is a great new software that takes all the guess work out,
https://ShineRanker.harveysmarketing.net
thanks
Harvey
Are you tired of constantly paying monthly fees for your domain and hosting services? Well, say goodbye to those costs and hello to unlimited profits with Domain Pro!
With the ability to have your own domain and hosting selling platform, add millions of TLDs, and offer top-notch services at your own prices, you can finally cancel those costly monthly subscriptions for good. Plus, with lightning-fast hosting included, you won't have to worry about paying extra for speed.
It's time to take control of your online presence and start profiting today! Don't miss out on this limited-time opportunity, visit www.taiversetech.com/domainpro now and join the 98% who have already cancelled their monthly subscriptions.
Hi,
As i was browsing your website przeglad-urologiczny.pl and it's search engine rankings i couldn't stop writing you this message.
If you are tired of struggling to get your website to rank on the first page of Google
& you want to increase your online visibility and drive more traffic to your site, let me share you something.
This can be a True Life saver for your website & business on 2023 https://bit.ly/backlinkmker , the ultimate backlink building software that can help you achieve just that. This software is designed to help you build high-quality backlinks from reputable sources, which is one of the most important factors that Google and other search engines consider when ranking websites.
With https://bit.ly/backlinkmker , you can:
âş Easily find and connect with relevant websites to build backlinks
âş Monitor your backlink progress and track your competitors
âş Boost your search engine rankings and drive more traffic to your site
âş Don't miss out on this opportunity to take your website to the next level.
Try BacklinkMaker today and see the difference it can make for yourself.
Best regards
[PRICE INCREASE ALERT] ChatGPT5 Email Hoster + Lead Generator
...the crazy part of this newly released app is it's ability to not just only kill your present and future expenses but also generate you targeted leads that grow your message, website traffic and conversions all in 60seconds...
(Price increase in 4Hours)
Hello buddy, I just discovered something really crazy and I felt you should see it too..
Itâs the ultimate communication barrier breaker.... for years marketers have struggled with steadily-communication with their audience.
Traditional autoresponders like aweber, getresponse and convertkit have made everything worse⌠from low open rates to emails landing in spam box⌠and then boom they block your account unjustly or impromptu..
See My Solution Here >>> https://bit.ly/chatgpt5
What if i showed you this newly built Chatgpt-enabled mailer that doesnât just send unlimited emails to unlimited subscribers for you but it also generate leads to send to for you in less than 60seconds..
It studies your writing pattern, craft human-like emotional driven messages from any voice note or recording and help you send it to yours or self-generated thousands of subscriber in 120 seconds.
âş No email delay
âş No limit on email send
âş No subscriber limit
Send text, audio, whatsapp messages and many more⌠in the push of a button
If you have a message youâd like to share with your audience, be it email, text, voicenote or even music snippet⌠this is the ultimate solution giver + itâs AI enabled, so you can craft your message yourself or you can tell the ultra-telsa AI to craft the message itself from your voice.
Click To Secure Your Copy >>> https://bit.ly/chatgpt5
...Get it right away as it's a limited edition and only open to a 100 customers starting from today.....
Cheers
Perry M
Hello!
I came across your website and was impressed by the substantial amount of organic traffic it receives. As an expert in customer acquisition, I have a proven method that helps businesses acquire new customers without any advertising costs.
I'm confident that I can deliver 20-40 qualified appointments for you starting from next week through this innovative strategy. If you're interested in growing your business and acquiring new customers, I'd love to share more details with you.
And as a bonus, if you simply take a few minutes to hear me out, I'll design a custom 4K logo for your website/brand completely free of charge.
This will give your brand a fresh and professional look, enhancing your online presence and attracting even more customers. Mind if I send over more info?
Best,
Tyler
Not interested? Unsubscribe Here.
https://forms.gle/fvik4cDbARCZd5S99
Hey,
Are you tired of working on daily schedules?
Would you like me to share a coaching that's allowing even me to generated steady income every single week ?
You can ignore this email if you are already making atleast $10k a month.
A proven Exclusive coaching that help build your own business in just 30 days with Guarantee is really hard to find.
If you are interested then you can check this out: https://www.xoxourl.com/10kin30days
Cheers
I have a secret to share with you. Something that has the power to transform your online life and bring you the traffic, followers, and recognition you deserve.
Here's the catch. This isn't your average, everyday solution. No boring content ideas or generic advice. I'm offering something unique and innovative that will set you apart from the rest.
I have the solution you've been searching for - a combination of content ideas and romance that will take your online life to the next level.
You'll have to see it to believe it. Follow the link below to learn more about - The Key to a Better Online Experience.
https://bit.ly/2wenty2hospitality
But don't take too long, this opportunity won't last forever.
https://bit.ly/2wenty2hospitality
Professional cold calling and appointment setting services. 4.50 usd per hour. 20 years experience. call or text shaun +1 956 433 3341
This Award Winning Weight Loss Healthy Supplement is also GMP Certified, FDA Approved Non-GMO Diet Supplement, which includes Exotic Earthly Herbs Such As Golden Algae, Dika Nut, Bigarade Orange and Many More.
Check it out: https://bit.ly/40Li7fT
Get It Now With 40% Discount!
Are you tired of spending countless hours creating and designing Instagram content? Look no further than Social Studio AI! Our platform allows you to automate your content creation, design, and posting, all with the help of your own personal AI assistant.
Join now for free, click here: https://socialstudio.ai/?ref=socialstudiospecial
Are you tired of spending countless hours creating and designing Instagram content? Look no further than Social Studio AI! Our platform allows you to automate your content creation, design, and posting, all with the help of your own personal AI assistant.
Join now for free, click here: https://socialstudio.ai/?ref=socialstudiospecial
This is your one time opportunity to automate your social media accounts with superior content.
Join now start for FREE click here: https://socialstudio.ai/?ref=socialstudiospecial
Do you need targeted Customers emails and phone numbers , so I am here to help you check out my Fiverr 5 stares profile serving over 880 happy customers
contact me here and tell me what you need ===== > https://bit.ly/42sRQnJ
So you there
Regards
Awals
Do you need targeted Customers emails and phone numbers , so I am here to help you check out my Fiverr 5 stares profile serving over 880 happy customers
contact me here and tell me what you need ===== > https://bit.ly/42sRQnJ
So you there
Regards
Awals
Do you need targeted Customers emails and phone numbers , so I am here to help you check out my Fiverr 5 stares profile serving over 880 happy customers
contact me here and tell me what you need ===== > https://bit.ly/42sRQnJ
So you there
Regards
Awals
Hi
Thank you for the fast delivery to my office.
When I received the order. I immediately saw that
something was wrong with it, and when I opened it, the item was unfortunately
broken.
I made a picture so that you can see what I have received. https://photoscreenshot.com/proofdamageorder
I am a regular customer, and I regularly order from your webshop.
Hope we can solve this small problem in a good way.
Yours sincerely
Lynne Bushell
"Sent from my Samsung"
Hello
Thank you for the quickly delivery to my home.
When I view the item. I immediately saw that
something was wrong with it, and when I opened it, the product was unfortunately
damaged.
I made a photo so that you can see what I mean. https://photoscreenshot.com/proofdamageorder
I am a regular customer, and I regularly order from your shop.
Hope we can solve this small problem in a good way.
Greetings
Finley Petrie
"Sent from my Samsung"
Hi there,
Monthly Seo Services - Professional/ Affordable Seo Services
Hire the leading seo marketing company and get your website ranked on search engines. Are you looking to rank your website on search engines? Contact us now to get started - https://digitalpromax.co/lb/ Today!
Hey,
I was researching about adult toys this afternoon and stumbled upon your blog â a great collection of high-quality articles.
I am reaching out to you because Iâd love to contribute a guest post to your blog.
I promise to fill the piece with solid points and actionable tips. I contribute regularly to blogs .
Here are some topics:
[Why do people like to use sex toys?]
[How do I introduce my wife to sex toys?]
[Sex Bloggers name their favorite Sex Toys]
Let me know and Iâll be sending you the draft as soon as possible.
I look forward to hearing from you soon.
Adutoys Team
Ever felt life has more to offer? From success to love, from travel protection to personal growth, we provide unique tools to enhance your journey. Expertly handled by our professionals, we guide you in areas like business, relationships, and even academic success. Curious? Explore with us and see life from a new perspective. [Book An Appointment] today.
Use Code : LIMITED25 ; Access the offer here: https://bit.ly/magickal2
Hi there!
Top Rated SEO Agency. Personalized Service from Dedicated Account Team. ROI Driven. Relationship Focused. Custom SEO Strategy. 95% Client Retention Rate. Services: Analytics, Back-end Development, Competitive Research, Consulting. Buy now: https://alwaysdigital.co/la/
Psst. If you have web development/ designing requirements, feel free to see more details at: https://outsource-bpo.com/website/
Ever felt life has more to offer? From success to love, from travel protection to personal growth, we provide unique tools to enhance your journey. Expertly handled by our professionals, we guide you in areas like business, relationships, and even academic success. Curious? Explore with us and see life from a new perspective. [Book An Appointment] today.
Use Code : LIMITED25 ; Access the offer here: https://bit.ly/magickal2
Hi, I have a ton of leads that want to pay for your products / services. When do you have a second to chat about them? Would you be willing to do a comission on the leads I send over? Please reply with your best phone number so that we can discuss. -Mark W.
AI is here to change the world, and people are going crazy over it
So the question is, would you like a piece of that pie?
BrainBox - The Worldâs First AI App Let You Launch Your Own âChatGPT-likeâ AI Chatbot with 50 stunning AI features
You can even customize this AI Chatbot with your own domain, branding and style and charge people for using it.
Forget paying huge fees for Content Writers, Programmers, Designers, Translators, Video Editors, SEO Experts, Customer Support, etc
BrainBox handles all of that for you 100%
>> Click Here To See The Live Demo & Get Full Access Before Price Increases
Use my coupon code: bit.ly/BrainBoxDiscount
To get access to BrainBox you need just 4 easy steps away
Step1: Login to BrainBox Cloud-Based App ( super-easy to navigate dashboard)
Step 2: Create- With Just One Click, Create Your Very Own ChatGPT-Like AI Chatbot( this takes just few minutes)
Step 3: Now Launch- Youâre Ready To Charge Millions Of Hungry Customers For Using Your Very Own AI Chatbot.
Step 4: Start Getting Paid by your Customers and Clients
BrainBox comes with over 50 AI features that which includes ;
Write engaging, high quality content for videos, blogs, scripts, emails, newsletters, ebooks literally anything
Turn plain text into engaging, professional videos that attract thousands of free hits of traffic
Generate the best AI designs that put 99% of graphic designers to shame, in just seconds
Design salespages, sales funnels, fully functional blogs
Proofread your writing without paying anything
Translate your writing to over 50 different languages and profit
Thatâs just a tiny fraction of all the features that BrainBox has to offerâŚ
Using BrainBox will give you full control and cut down your expenses on hiring freelancers that give you low service .
>> Get Unlimited Access to BrainBox AI Technology
bit.ly/BrainBoxDiscount
And to make this a no-brainer, the first 25 people will get full access to my 100 bonuses.
PS: If you act now, you will instantly receive [bonuses] worth over $14,659.44... This bonus is designed specifically to help you get 10x the results, in half the time required
>>Click here to secure your access to BrainBox today
bit.ly/BrainBoxDiscount
Sincerely,
James
Hello There,
We have some opportunities ready and waiting. curious? Just click on the link below to get the ball rolling:
https://rokl.ink/increased-sales
Best wishes,
Thomas Wilson
//Optout//
To unsubscribe from our communications going forward, please opt out at https://rokl.ink/optoutone
Hey, there! My name is Wil and I have a MASSIVE list of leads that are interested in buying from you. Is this a good place to to send you more information about the leads? Let me know.
Good Day,
There are some leads waiting for you. some new leads? Just follow the link below to get the ball rolling:
https://rokl.ink/increased-sales
Best wishes,
Thomas Thompson
//Optout//
If you wish to stop receiving from our communications in the future, please opt out at https://rokl.ink/optoutone
NEW "60 Second Side Hustleâ Banks A Crazy $61 Per Hour..On Complete Autopilot... Making Me Over $1,300+ Per Day! https://bit.ly/47m5wCF
This is seriously perfect for you bit.ly/3tSF9GN
7 page static website/ Contact form/ Slider - starts from $80
Unlimited categories/ products/ Slider/ Contact form/ Payment gateway integration/ Ecommerce website - stats from $300
All websites are mobile responsive and SEO friendly. Professional and afforable website design and development
Hire our developers at https://speedexpert.co/wp-development/
I saw something wrong with your Google Map listing, is this a good place to send a report of the issues I found?
Hi, I noticed a few problems affecting your website on Google, is this a good place to send them?
Affordable Website Design with High Quality. Receive a complimentary quote for Free Web Designing, including a 5-page website with Free Flash, Contact Forms, and a basic Logo, all backed by our satisfaction guarantee. Enjoy UNLIMITED revisions for the prototype, Free basic SEO, and adherence to W3C standards.
Our Corporate, Business, and Informational website package is priced at $80 and will be completed within 4 days. Trust us to create your online store, with packages starting at $150.
Benefit from our development center in Bangalore, offering the highest expertise at the lowest cost. Contact us NOW for more information. https://outsource-bpo.com/website/
We also do Monthly SEO Services at https://digitalpromax.co/la/
Discover How We Make $25/min with GPT
Get our Most Profitable AI Apps for Chat-GPT
*NEW* AI Apps Bank Us $194/Hour With AI
Case Studies: $120 to $5k/Day Revealed
*EXPOSED* SECRET Free AI Tools for Profit
Make 100% With Resell Rights Included!
Fast-Track Your AI Profit in 2024.. in 1 Click!
Get the Elite 2024 Tech of The #1 AI Profiteer
100% GUARANTEED you NEVER SAW these AI Tricks in ALL of 2024.. or 5x your money-back!
click here so see it
https://warriorplus.com/o2/a/y53jnb/0
thank me later
Professional Web Designers - For Hire
Need a Website Built For Your Business? Get an Experienced Dedicated Designer From Us.
Our website development services can create your dream website. We design engaging and user-friendly websites that improve the customer experience, we work with you to understand your business goals and preferences. From simple blogs to complex e-commerce platforms, we are dedicated to delivering high-quality solutions that exceed your expectations. Let us bring your vision to life and enhance your online presence.
Talk To Our Software Experts Today Chat With A Live Representative https://outsource-bpo.com/website/
Audiobooks is now the BIG goldmine, and people are making huge profits with it on a daily basisâŚ
Sadly, creating and selling them can be tough and super-expensive.
But I have got good news for youâŚ
Meet Vox AI
The Worldâs First ChatGPT4-Powered AI App That Turns Any "Text, URL, Website, Article, Keyword, Blog, Document or PDF" into High-Quality Audiobooks or Podcast In 660 Different Voices & 80 LanguagesâŚ
>> Click Here To See The Live Demo: bit.ly/VoxAiOffer
With Vox AI, you can generate content on any topic using âSiri-Likeâ voice command & turn it to Audiobooks, Podcasts, or Voiceovers for VSL, TV Commercial, Webinars, Sales Videos, etc
...Publish To The Built-In Marketplace with 2.3M active users, Sell & Receive Instant Payments Via Multiple Methods, including Paypal, Stripe, Cards, and Bank AccountsâŚ
>> Click Here to Get Instant Access to Vox AI and Sell On Automation: bit.ly/VoxAiOffer
Coupon Code - VOX5OFF (strictly for the first 12 people)
Even if you are a newbie with zero knowledge⌠VoxAI is your best shot.
You can easily Activate VoxAI in 3 simple steps & start your audiobook empire:
Step 1: Login - Login to VoxAI Cloud-Bases App
Step 2: Generate- Enter a Keyword, article, PDF, or even a URL⌠and VoxAI will turn them into a Full Audiobook or Podcast
Step 3: Publish- publish your audiobooks on our built-in marketplace with 2.3 million active users.
Step 4: Start Profiting as soon as you are done
It is as simple as that.
>> Get Lifetime Access Here: bit.ly/VoxAiOffer
With Vox AI, you canâŚ
Create Your First Audiobook Within 2 Minutes
Turn Any Article, Website, Url, PDF or Blog Into Audiobook, Podcast, VSL, Audio/Music TrackâŚ
Create A Podcast With Human Voice Without Recording
Choose From 660 Real Human Voices
Create Voices In 80+ Different Languages
Comes With 50+ Built-In AI Features That Will Make Your Life 100x Easier
We Donât Even Write Scripts, We Let AI Do It For Us.
Publish Your AudioBook To Our Marketplace With 2.3 Million Active User
Publish your AudioBook Or Podcast To (Spotify, Audible, Scribe)
No Complicated Setup - Get Up And Running In 2 Minutes
âŚAll these, and many more without Paying Any Monthly Fee
>> Click Here To Get Earlybird Access (Ends In 2 Hours From Now): bit.ly/VoxAiOffer
Coupon Code - VOX5OFF (strictly for the first 12 people)
Fair Warning - Go In Now To Avoid Paying Monthly Fee Later
Sincerely,
John
If you hire a wordpress developer in your country, they will charge you in two ways
1. Project basis
2. Hourly Basis
Project basis - the minimum rate for a ecommerce website starts $1000, But if you hire us, You can save more than 65%
Hourly basis - The minimum rate for an experienced Wordpress developer is $15, But you can hire us at $6/ hour
I can send the resume/ CV of my developer and the samples of the work done.
More details: https://wpexpertspro.co/website/
We also do Best Monthly SEO Services. Individual SEO strategies, tailored from the scratch. Generate more leads, sales & revenue.
We help companies rank page #1 and reach their true potential online. Weâll show you exactly what weâll do, how much itâll cost, and how weâre going to crush your competitors.
Talk Customized SEO Strategy with Our Team Today. - https://digitalpromax.co/la/
Can I send you something to help your website use AI?
Hi, We can swiftly Provide reviews to your business.
Our Platinum service guarantees a greater than 90% success rate for Permanent reviews within few hours, with pay per review.
Our value proposition is simple: We work directly with sites like Google, Yelp, AVVO, Glassdoor and Indeed, saving you time and energy so you can focus on growing your Business. You only pay us per successfully review.
Would you like to learn more about our Platinum service for your Business reviews?
Boost your reputation today. Contact us at kabnitofficial@gmail.com or WhatsApp at +923127606682.
Hello, I made a free marketing video for your website, Is this a good place to send it?
Reply to marketingvideosbyai@gmail.com
To unsubscribe reply with the word unsubscribe in the subject.
Discover the power of serendipity with our "GAIN Unexpected Romantic Encounters" rite at Magickal.net. Guided by the mystique of Dantalion, this rite aligns cosmic forces to bring unexpected romantic opportunities your way, fostering genuine connections for lasting love. Ideal for those seeking love in the most unexpected places, this rite is a harmonious blend of ancient energies designed to open your path to enchanting encounters.
https://www.magickal.net/gain-opportunities-for-unexpected-romantic-encounters
As a special offer, use code:limited25 for an exclusive 25% discount on this transformative experience. Embrace the magick of chance and let love find you in the most unexpected moments.
Warm regards,
[Valeria]
Magickal.net - Where Magick Meets Destiny
AI vs. Your Website: A Fight for Survival
Click here https://aiearndaily.com
I will design you a custom Open Chat AI for przeglad-urologiczny.pl.
I will Volunteer to get you started but only if you ACT NOW!
Click the link here https://aiearndaily.com
You can OPT OUT here:
https:///mybotboss.com/opt-out/?customer_domain=przeglad-urologiczny.pl
Us Website owners need a money making hobby not just any hobby.
i found one that is suitable for specially this year and the next 2024 & 2025.
Its BTC and altcoin longs. since ETFs has been approved a multitude of new investors and institutions has entered the Crypto Scene making it an easy task to make money there.
the simplest way is to long any coin you see the future in.
check it here: https://www.binance.com/en/futures/ref/800215201
Experience a comprehensive array of magickal rituals performed by adept practitioners, tailored to fulfill your diverse needs (GET What You need, choose from the wide array of spells at an affordable price)
Use Code: LIMITED25 for 25% off
https://www.magickal.net
Here are the Business-Boosting Benefits of SEO
1: Brings Organic Search Traffic to your Website
2: Generates Leads Cost-Effectively
3: Increases Brand Awareness
4: Gets You Ahead of the Competition
5: Gets More Foot Falls in your Physical Store
Use our Monthly SEO Services for good results: https://digitalpromax.co/
(just a couple of days from now)
ďťż
Working from home is becoming increasingly popular.
With your computer and a little training, you could make some bucks from the comfort of your home.
And you can speed up the arrival of your initial paycheck.
ďťż
Click here if you are interested-> https://700561pdp8kzkw3kr5s-wl33xm.hop.clickbank.net
If you are one of those eager to start a different stage in their
lives and make more bucks while working in your spare time,
this job might suit you. With minimal effort and no prior experience,
you could gain the same day you apply.
ďťż
Take advantage of this out - grab this and begin right away.
Confirm your interest by clicking the button below, and you can see that
the first payment will arrive in as little as a couple of days.
Regards,
Willson
To unsubscribe reply with the word unsubscribe in the subject line to fullwebsiteaudit@gmail.com
Please look at our Fiverr Gig - https://www.fiverr.com/absglobal/write-and-post-human-style-written-articles-daily-for-a-month-with-proper-seo
Cannabis companies! Raise your ROI by subcontracting your veg and nursery to a trusted partner and professional clone company specializing in Tissue Culture remediation for cannabis genetics. At Exotic Nurseries, weâre dedicated to customer service and providing the healthiest and strongest cannabis genetics on the market. Buy your next round of clones from Exotic Nurseries and experience the difference in starting from fully reinvigorated genetics with cuts from a fully tissue cultured mother every time you plant.
Are you a cannabis company who would you like to raise your ROI?
Exotic Nurseries is here to offer you the opportunity to save big in the garden by shutting down your veg space for mothers and babies and relying on us to supply your garden with the best starts possible. Schedule custom orders ahead of time or choose from our large selection of inventory of clones, preteens and teens that is rooted and ready to go 24/7.
Contact us now!
Owners/Operators
Jeff
734-223-2418
&
Kyle
734-635-7340
Exoticnurseriesllc.com
Find us on google, and instagram
Google link:
https://g.co/kgs/5EDMNt
Instagram link:
https://www.instagram.com/exotic.nurseries?igsh=Mzg1MmdoMHJqc3o0
By far, the biggest mistake men make when they want to make a woman wetâŚ
Is thinking that LUSTING FOR YOU somehow comes from LIKING you.
But nothing could be further from the truth.
You see, whether or not a girl âlikesâ you and approves of youâŚ
Has nothing to do with whether or not she wants to wrap her legs around you and draw you deep inside her.
In factâŚ
Women are more likely to fantasize about getting bent over and ravaged by a guy they donât particularly âlikeâ in the traditional sense.
Discover how to make her fantasize about getting pounded by you here
==> https://cb0b7yrgodl5gkf5flilycvjqe.hop.clickbank.net
Thatâs because LUST and LIKING exist in different areas of her brainâŚ
âLikingâ is generated in the rational, logical part of the brainâŚ
And lust is activated in the deeper, more primal, animal part of the brainâŚ
The good news isâŚ
That a womanâs primal, animal brain is much more powerful than her logical, reasonable oneâŚ
And guys who know how to activate itâŚ
Have an insane amount of choice with women..
Hereâs how to activate the LUST part of her brain
https://cb0b7yrgodl5gkf5flilycvjqe.hop.clickbank.net <== Watch now
When you think about it, we men arenât that different:
Iâm sure thereâs been a girl you didnât particularly âlikeâ or connect withâŚ
But you wouldnât hesitate to slide into bed with her and tear her panties off.
The main difference between menâs and womenâs brainsâŚ
Is where a manâs primal lust is triggered by a womanâs physical appearanceâŚ
A womanâs primal lust is triggered by the signals his body language gives offâŚ
Thatâs why carrying yourself a certain way will make a woman squirm in her seatâŚ
Itâll make her want to reach down and start touching herselfâŚ
And sheâll be picturing your face as she crests overâŚ
Learn how itâs done in this short, instructional video: https://cb0b7yrgodl5gkf5flilycvjqe.hop.clickbank.net
Thank me later...
-Jordan
To unsubscribe reply with the word unsubscribe in the subject line and include your domain name to media.acquisition1@gmail.com
https://baccaratpredictionsoftware.com
Struggling to Rank your Website In Google? Imagine your website buried in search results, missing out on valuable leads and potential customers.
Propel Your Business to New Heights with Monthly SEO! Top Rankings, Increased Traffic, Business Growth and Profit.
Experience the transformation. Rank your website on the first page, attracting targeted traffic, and converting visitors into loyal customers.
Introducing Out Monthly SEO - Your Gateway to Online Success!
â
Tailored Strategies: Our Monthly SEO adapts to your business needs.
â
Proven Results: Check our success stories for real transformations.
â
Start Today: Elevate your online presence with a click.
Ready to See Your Website Rank? - https://digitalpromax.co/?src=m24przeglad-urologiczny.pl
We have iptv and other all payment soluation
Gobuypro.com
** Paypal balance to buy bitcoin safely way we have.
0.í ˝íąEuropean All Country Paypal account available Persona & Businessâ
1.í ˝íąUK/USA verified Business & Personal PayPal Accountsâ
2.í ˝íąBinance Verified/Verified plusâ
3.í ˝íąCashapp VCC activate/BTC enableâ
4.í ˝íąWise Personal/Business accountâ
5.í ˝íąRevolut business accountâ
6.í ˝íąBuy Aged Facebook account 5 year oldâ
8.í ˝íąPayoneer/Venmo/Pst.net account availableâ
9.í ˝íąAny $ Dollar exchange serviceâ
10.í ˝íąUnlimited email sending software life timeâ
12.í ˝íąBuy USA bank+ credit card account with all accessâ
í ˝íłĽContact í ˝í˛
Whatsapp: +44 7308 244260
Telegram: @gobuypro
Skype: live:.cid.236f261e6814fdd8
Mail: gobuypro@protonmail.com
Content written is not about writting anything on your website. It may harm your website rankings.
You need to write the articles strategically considering all SEO and product related analysis in mind.
Here we do this work on your behalf to post regular articles to grow your organic traffic and ofcourse the Search engine rankings as well.
Subscribe today and see the results yourself in just 1-2 months.
Our Content Writing SEO Plan - https://dobadu.com/product/daily-seo-content-writing-posting/
Once your purchase is confirmed, our executive will get in touch with you related to your website & Product/Services details.
Note: You can also contact our Live Chat support available on our website for any questions you might have.
Limited Time Offer, Until April 15. 2024! í źíżď¸
seize the opportunity!
Let us help you . click here: https://mattpar.com/tube-mastery-ds#aff=Aldonvc
Are you interested in starting or scaling a YouTube channel, without having to show your face or becoming a traditional YouTuber?
WHEN YOU JOIN TUBE MASTERY 3.0 TODAY WEâLL EVEN THROW ON THE âQUICK STARTâ BONUSES
MattPar
Step-By-Step Checklist (Value: $97)
MattPar
âList Of 239 Example Channels (Value $297)
MattPar
âPrivate Facebook Group (Value: Priceless)
MattPar
Video Ideas Template (Value: $27)
MattPar
ââScript Templates For Video Creation (Value: $297)
MattPar
ââVideo Creation Assembly Line Template (Value: $997)
MattPar
YouTube Gear List (Value: $97)
MattPar
List Of Stock Footage, Music, Photos (Value: $297)
MattPar
ââFair Use Checklist (Value: $497)
MattPar
ââVideo Optimization Checklist (Value: $979)
MattPar
ââList Of Affiliate Programs (Value: $997)
MattPar
ââList Of Places To Hire People From (Value: $97)
MattPar
ââScript And Job Post Templates For Hiring (Value: $997)
MattPar
ââHow Much To Pay For Video Creation Cheatsheet (Value: $497)
MattPar
ââRecommended Software And Tools (Value: $97)
MattPar
ââPersonal Brand Secrets (Value: $997)
MattPar
ââDoing This From A Phone (Value: $97)
MattPar
ââBusiness And Taxes (Value: $297)
MattPar
ââTube Channel Case Studies (Value: $97)
MattPar
Tube FAQ Course (Value: $297)
MattPar
ââTube Secrets Course (Value: $97)
Let us help you . click here: https://mattpar.com/tube-mastery-ds#aff=Aldonvc
Can you provide me with a list of your industry certifications or recognitions?
Corey, Mcpherson
3127 Ingram Street, Dayton, OH, 45402, United States.
22717447
If you do not wish to receive further emails from us.
Please note that it may take up to 10 business days for your request to be processed.
If you have received this communication in error, please delete it and notify the sender immediately.
DO YOU WANT MORE BUSINESS ? GET on TOP of the NEAR-ME Results to Crush Competition.Drive more calls ,more clicks and more leads.
Increase Traffic & sales fast
Multi-keyword Map Rankings
Image Optimization
FUlly Automated Tracking and Reporting
40 Super Citations
Full 9 Point Google Business Profile Optimization
To Schedule a demo of the most robust reporting on the market: You will see
Animated 7x7 mile grid reports
grraph compare by ,week , month and year
PPC cost per click value of each keyword
Global account overview
Automatic Montly reports
This is the only tool that tracks NEAR ME keywords
Schedule your Demo now
See reults in as little as 30 Days
respond that you are intrested and someone will call you to set up a good time for the Demo
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to claim free rendering.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Enjoy 20 free active followers and see our service quality. Like it? Purchase more to grow your audience. Itâs a win-win!
Why Choose InstaFollowers?
-Cheaper than ads
-Trusted by agencies
-Loved by freelancers
-Quick delivery
-Reliable service
Simply visit our site, select the $9 package, and enter coupon code "EX9PM" on the checkout page to claim your 20 free followers.
Claim now at https://instafoll0wersapp.com/
Coupon Code: EX9PM
No fees, no credit card needed! Used by freelancers and agencies. Experience it directly!
To claim the offer, visit https://instafoll0wersapp.com/, click "Claim Your 20 Followers Coupon", navigate to the checkout page, enter your details,
add and validate the coupon code on the bottom right side, and you will see that you have to pay $0 if you selected the 20 followers package.
Then place the order. This coupon provides a one-time $9 discount for any order. You can try out the 20 followers package for free.
Rayan
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +1 315 636-5905
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Learn More - https://www.flyingvertexstudio.com
or
Reply "Yes" to this Email to get FREE quote.
Best Regards,
Rahul Mehra
Cell - +91 7982604575
WhatsApp- https://wa.me/+917982604575
Email - flyingvertex@gmail.com
Website - https://www.flyingvertexstudio.com
Looking for a Great Job?
75% of resumes arenât even seen by hiring managers!
Is your resume keyword rich and ATS ready?
Find out with our FREE consultation with a certified, trained resume writing.
Send your resume to resumes@razoredgeresumes.com to make sure you are not missing out!
Send your resume now and we will reach out to you to speak at your convenience.
Quick and easy. Start today!
* * * * * * * * * * * * * * * * * * * *
100% free online courses from the International Trade Council with the ITC Academy
* * * * * * * * * * * * * * * * * * * *
Our expert-led online courses in international trade, import/export, intellectual property, and supply chain management are designed to elevate your career. Join us to gain valuable insights, practical skills, and a competitive edge in the global market.
Why Take an Online Course?
- 100% Onlne: Study in your own time - anywhere in the world
- Totally Free: No cost for all courses and certificates.
- Expert Instructors: Learn from industry professionals.
- Comprehensive Curriculum: Covering key aspects of international trade.
- Flexible Learning: Study at your own pace, anytime, anywhere.
- Regular Updates: New courses added weekly.
- Free Certificate: Earn a certificate upon course completion.
Enroll free today and start your journey to success!
Visit https://www.internationaltrade.academy to sign up.
Hi there!
Are you looking to maximize the impact of your YouTube videos? Introducing YTCopyCat, our innovative SaaS tool that converts your YouTube videos into various high-quality written content using advanced AI.
What Can Our Tool Do for You?
Blog Articles: Turn your videos into blog posts.
Newsletters: Generate captivating newsletters effortlessly.
Video Summaries: Create concise summaries.
Tweets: Produce engaging tweets.
Custom Content: Use personalized prompts for specific needs.
How It Works:
Paste your YouTube video link.
Our AI analyzes and extracts key content.
Choose your desired format.
In just a few clicks, youâll have top-notch content ready to publish or share. Save time and boost productivity with automated content creation.
Why Choose YTCopyCat?
Time-Saving: Automate your content creation.
Versatile: Generate multiple content types from one video.
High Quality: Enjoy superior content with advanced AI.
Special Offer:
Try YTCopyCat for free and revolutionize your content strategy. Visit https://ytcopycat.com to learn more and start your free trial today. Donât miss this chance to enhance your content creation!
Cheers,
Fabien
contact@ytcopycat.com
Dear przeglad-urologiczny.pl owner or manager,
Cut your business or personal credit cards and loan payments in half. eliminate interest and reduce your debt by 50%. 100% guaranteed. The average customer saves $56,228 in unnecessary interest plus principal and 15 years in payoff time through our consolidation loan and debt consolidation programs.
Contact us at usdebtrelief.biz or email me at usdebt12@gmail.com I look forward to hearing from you,
Rey
Nazywam siÄ Ahmet. PracujÄ w tureckim banku. Szukam kogoĹ, kto ma tÄ samÄ
narodowoĹÄ co ty. Obywatel twojego kraju zmarĹ w niedawnym trzÄsieniu ziemi w Turcji i miaĹ na naszej bankowej lokacie staĹej 11,5 miliona dolarĂłw.
Kierownictwo mojego banku jeszcze nie wie o jego Ĺmierci. JeĹli mĂłj bankowy pracownik dowie siÄ o jego Ĺmierci, wykorzystajÄ
Ĺrodki dla siebie i wzbogacÄ
siÄ. ChciaĹbym temu zapobiec, ale tylko z TwojÄ
wspĂłĹpracÄ
. DowiedziaĹem siÄ o tym, poniewaĹź byĹem menedĹźerem jego konta. W zeszĹym tygodniu kierownictwo mojej banku przeprowadziĹo spotkanie w celu audytu bankowego, aby zidentyfikowaÄ nieaktywne i porzucone konta. WiedziaĹem, Ĺźe to siÄ wydarzy i dlatego szukam rozwiÄ
zania, aby poradziÄ sobie z tÄ
sytuacjÄ
, poniewaĹź jeĹli mĂłj bank odkryje jego ĹmierÄ, skierujÄ
Ĺrodki do zarzÄ
du. Nie chcÄ, aby to siÄ wydarzyĹo.
ProszÄ o TwojÄ
wspĂłĹpracÄ w celu przedstawienia CiÄ jako krewnego/spadkobiercy konta, poniewaĹź masz tÄ samÄ
narodowoĹÄ co on. Nie ma ryzyka; transakcja odbywa siÄ na podstawie umowy prawnej, ktĂłra chroni CiÄ przed naruszeniem. ProponujÄ podziaĹ funduszy 60/40, z 40% dla mnie. PotrzebujÄ tych funduszy na operacjÄ mojej cĂłrki, wiÄc proszÄ o zachowanie tych informacji w tajemnicy. Skontaktuj siÄ ze mnÄ
e-mailem, abym mĂłgĹ przekazaÄ wiÄcej informacji: reachahmet@proton.me
Are you still looking at getting your website done/ completed? Contact e.solus@gmail.com
Attn:
Dear Sir/Madam,
Do you want to become a vendor/supplier/contractor of Etihad Airways Projects & Contracts Management? We are looking for a reliable, innovative and fair partner for 2024/2025 projects, tasks and contracts. Kindly indicate your interest by requesting a pre-qualification vendor questionnaire and EOI. With this information, we will analyze whether you meet the minimum requirements to collaborate with us.
Best regards,
Osama Tanzeel Alam
Project Coordinator
Group Procurement & Contracts Shared Services Center
Etihad Aviation Group PJSC
Advantages of hiring a Developer:
Specialized Expertise
Tailored Customization and Control
Time and Cost Efficiency
Custom Plugin Development
SEO Optimization
Ongoing Support and Maintenance
Seamless Integration and Migration
Scalability for Business Growth
Hire a web developer now from us. Contact us at https://wpexpertspro.co/website/?site=przeglad-urologiczny.pl
Hi przeglad-urologiczny.pl Owner,
Struggling with Live Chat Issues?
Slow response times and missed chats can create a stressful environment for your team and frustrate your customers.
What If It Gets Worse?
As these issues pile up, you risk damaging your reputation and losing business. Itâs a tough situation to handle alone.
Hereâs Some Hope:
You donât have to face this by yourself. Our live chat solutions can:
Speed Up Response Times: Ensure quick, effective support.
Scale with Your Needs: From startups to large enterprises.
Expert Agents: Professional and efficient chat handling.
Ready for a Change? Free 30 days trial.
Email us at lisa365chat@gmail.com to schedule a free consultation and discover how we can help you streamline your live chat operations.
Advantages of hiring a Developer:
Specialized Expertise
Tailored Customization and Control
Time and Cost Efficiency
Custom Plugin Development
SEO Optimization
Ongoing Support and Maintenance
Seamless Integration and Migration
Scalability for Business Growth
Hire a web developer now from us. Contact us at e.solus@gmail.com
Hi,
Are you seeking a fast and reliable business loan to fuel your growth?
At Fund Crowns Limited, we understand that every business is unique. Thatâs why we offer a diverse range of financing options tailored to meet your specific needs, including:
>> Expansion Loans: Scale your operations seamlessly.
>> Startup Loans: Kickstart your entrepreneurial journey.
>> Heavy Equipment Financing: Invest in the tools you need.
>> Real Estate Development Loans: Turn your property vision into reality.
>> Construction Loans: Build your future today.
>> Working Capital Loans: Keep your business running smoothly.
>> Bridge Loans: Access immediate funding when you need it.
>> Inventory Financing: Stock up without the stress.
>> Merchant Cash Advances: Get quick cash flow solutions.
>> Franchise Financing: Support your franchise dreams.
We are committed to providing you with the funding you need to achieve your business goals.
Ready to get started?
Visit us at www.fundcrownsltd.com or email us at loan@fundcrownsltd.com for personalized assistance.
Let us help you achieve your business goals with ease!
Best regards,
Dylan Pham
Fund Crowns Limited
The Strategy That makes Blackjack Players "The Millionaire", yes you got that right "Card Counting" is the only strategy that has edge over casinos if learnt precisely. It is not easy to learn but can be a piece of cake of practiced thru some genuine tools. Watch this video before it gets deleted and go for the Card counting software that will help you learn the card counting the easy way. No more talk, please watch - https://youtu.be/de3VfG7Zv2I?si=K9oUfIcmFxo_eHUC (Since our videos gets deleted quite often, i request you to watch ASAP)
Hey
Not sure how much money przeglad-urologiczny.pl is making, but selling digital products is on fire.
The transaction value in the Digital Commerce market is projected to reach US$7.63 trillion in 2024. (Statistica.)
There is a simple 2-step method to make money selling high-profit, digital products in less than an hour per day.
Start leveraging from this growing economy.
Learn how here:
https://hoply.io/Q5QNX
Still looking to get your WordPress website done, fixed, or completed? Reach out to us at e.solus@gmail.com & Prices starts @ $99!
Hi friend,
i want to ask u if u need loan , i can give u up to 100k without any questions, fees start from 2%.
u can take for long and short term, if u need please contact me
My Whatsapp: +353877761357
My phone: +17852122012
My email: anguslevie@gmail.com
Boost Your Business with Shopify - Only $1/Month for 3 Months!
Bring your ideas to life with Shopifyâs limited-time offer: Start now for a no-cost trial and get three months on Shopify for just $1/month on select plans. This is the perfect chance to migrate or launch your business without the upfront costs!
Why Shopify?
Shopify is a all-in-one platform that lets you build, customize, and control your online store with ease. Sell across multiple channelsâon your website, social media, or face-to-face.
With Shopify, you can:
- Effortlessly launch a beautiful online store
- Sell everywhere: online, mobile, social media, and beyond
- Handle products, transactions, and fulfillment from any device
Shopify handles updates and upkeep, so you can concentrate on expanding your business.
-- Get started for $1/month: https://bit.ly/shopify-free-promo
Take advantage of this opportunity to build your ideal store with Shopifyâs amazing offer!
Hi,
Meetings donât have to be chaotic or unproductive. With Fireflies ai, you can focus on decisions while we handle the details.
Hereâs what you get:
- Seamless recording and transcription for all your meetings.
- Clear summaries of key points and next steps.
- An easy way to search and share meeting insights.
Begin your free trial today and simplify your meetings.
Start now for free at: .https://businesstechgenius.com/FirefliesAi
Excited to know your thoughts!
Best regards,
Heather
Whenever you decide not to receive subsequent correspondence from us, please reply back with the message: "Not interested"
Travessa Polivalente 815, Island Park, NY, USA, 40450-330
Hi friend,
i want to ask u if u need loan , i can give u up to 100k without any questions, fees start from 2%.
u can take for long and short term, if u need please contact me
My Whatsapp: +353877761357
My phone: +17852122012
My email: anguslevie@gmail.com
Hey there,
Struggling to make the most out of your meetings? Fireflies ai is here to change that. It effortlessly transforms your meetings into meaningful insights.
- Captures, transcribes, and summarizes your sessions automatically.
- Ensures no key action items are missed.
- Lets you search past conversations instantly.
Begin using Fireflies ai now to see how it transforms your meetings.
_ Start your free trial today at: https://bit.ly/aifireflies
Your sincerely,
Beatrice
If at any point you prefer not to get additional messages from this email, please fill the form at https://bit.ly/removeuslist
Kongshoj Alle 68, Tonawanda, NY, USA, 2800
Hi friend,
i want to ask u if u need loan , i can give u up to 100k without any questions, fees start from 2%.
u can take for long and short term, if u need please contact me
My Whatsapp: +353877761357
My phone: +17852122012
My email: anguslevie@gmail.com
Hi,
I hope you are doing well.
We noticed a few issues with your website and SEO,. We have the free website and SEO audit reports to review with you. If you are serious about reviewing the audit reports we can schedule a Zoom meeting with our team. These reports are very detailed and essential to your online marketing. Please let us know if you would like to review the reports.
Kind Regards,
Elias Easton
Subject: IT Specialist Looking for Full-Time Remote Role with Your Company
Dear [Sir/Madam],
I hope this message finds you well. My name is Shaheen Iqbal, a dedicated professional from Pakistan with an MCS in Computer Science. Over the years, I have built a strong foundation in IT and mastered several programming languages, allowing me to excel in a broad range of technical and creative tasks.
With 12 years of freelancing experience, I have developed expertise in website management, social media marketing, graphic design, video editing, Microsoft Office tasks, email management, live chat query handling, data analysis, and more. I am highly skilled at managing multiple projects simultaneously and handling diverse responsibilities with precision.
I am now seeking a full-time remote position and believe your company offers the ideal environment for my skills and aspirations. I am flexible and can work across any time zone, ensuring seamless communication and efficient project delivery.
In addition to my technical skills, I am confident that I can help your company grow by enhancing your online presence, improving operational workflows, and providing innovative solutions. I am fluent in English, Urdu, and Punjabi, and for any written communication in other languages, I can easily use Google Translate to ensure clear and accurate communication. I would be thrilled to contribute to your team and would greatly appreciate the opportunity to discuss how I can add value to your organization.
Please feel free to reach out to me via email at shaheeniqbalonlineworking@gmail.com for further communication.
I look forward to hearing from you soon.
Best regards,
Shaheen Iqbal
Hi friend,
i want to ask u if u need loan , i can give u up to 100k without any questions, fees start from 2%.
u can take for long and short term, if u need please contact me
My Whatsapp: +353877761357
My phone: +17852122012
My email: anguslevie@gmail.com
The crypto bull market is heating up, and nowâs the perfect time to grab your free Bitcoin.
Just yesterday, hundreds of members jumped at the chance to claim theirs. Have you claimed yours yet?
Hereâs the deal: You can get $10 in Bitcoin (BTC), completely free â no catch, no purchase necessary.
Just attend one of this weekâs exclusive workshops, immerse yourself in the knowledge, and complete a short quiz.
$10 in BTC will be sent straight to your crypto wallet.
Click Here For More Info : https://bit.ly/4g2FMj4
This hack shocked the world after turning a simplistic WordPress site, with little traffic, into a profit-generating machine, despite being only a few days old.
They used a simple angle called âDaily Client Machineâ thatâs going viral everywhere on the internet.
Hereâs the article explaining exactly how they pulled this off: kumivitae.com
You should check it out if you are also running WordPress and need traffic desperately.
Coy, Hubbs
3658 Fieldcrest Road, Winston Salem, NC 27104, United States.
821456003
If you do not wish to receive further emails from us, you may opt-out by filling this form:
https://forms.gle/Vz7Ssxwvh38Ruxkz7.
Please note that it may take up to 10 business days for your request to be processed.
If you have received this communication in error, please delete it and notify the sender immediately.
Get More 5-Star Reviews & Rank Higher on Google! Contact us at reviewsninjas@gmail.com
Struggling to get reviews? 92% of customers check them before choosing a business, and more 5-star reviews mean higher Google rankingsâdriving more leads and sales.
Review Ninjas automates your online reputation so you can focus on growth:
â
Automated Review Requests â SMS & email follow-ups done for you
â
AI-Powered Responses â Engage customers & save time
â
Reputation Protection â Filter negative feedback before it goes public
â
Higher Google Ranking â More reviews = More customers
Try Review Ninjas FREE for 14 days and see the difference! Contact us now at reviewsninjas@gmail.com
Effortlessly create and manage a stunning, user-friendly local directory designed to bring value to your community
and grow your business. Whether youâre a local marketer or agency owner, Local Directory Fortune empowers you
to offer a valuable resource that showcases trusted businesses, builds relationships, and opens up opportunities for additional services.
Click Here For More Info : https://warriorplus.com/o2/a/cn10g50/0
âStep into Local Marketing Spotlight with Your Very Own Local Directory System & GPT-Powered Assistants.
Watch Business Owners Flock to Your Agency, Eager for Being Listed And Desperate for Marketing Services.â
Revolutionary Directory Platform for Unmatched Marketing Success.
Click Here For More Info : https://warriorplus.com/o2/a/cn10g50/0
Hi,
I am a senior web developer, highly skilled and with 10+ years of collective web design and development experience, I work in one of the best web development company.
My hourly rate is $8
My expertise includes:
Website design - custom mockups and template designs
Website design and development - theme development, backend customisation
Responsive website - on all screen sizes and devices
Plugins and Extensions Development
Website speed optimisation and SEO on-page optimisation
Website security
Website migration, support and maintenance
If you have a question or requirement to discuss, I would love to help and further discuss it. Please email me at e.solus@gmail.com
Regards,
Sachin
e.solus@gmail.com
Effortlessly create and manage a stunning, user-friendly local directory designed to bring value to your community
and grow your business. Whether youâre a local marketer or agency owner, Local Directory Fortune empowers you
to offer a valuable resource that showcases trusted businesses, builds relationships, and opens up opportunities for additional services.
âStep into Local Marketing Spotlight with Your Very Own Local Directory System & GPT-Powered Assistants.
Watch Business Owners Flock to Your Agency, Eager for Being Listed And Desperate for Marketing Services.â
Revolutionary Directory Platform for Unmatched Marketing Success.
Click Here For More Info : https://warriorplus.com/o2/a/cn10g50/0
Effortlessly create and manage a stunning, user-friendly local directory designed to bring value to your community
and grow your business. Whether youâre a local marketer or agency owner, Local Directory Fortune empowers you
to offer a valuable resource that showcases trusted businesses, builds relationships, and opens up opportunities for additional services.
Click Here For More Info : https://warriorplus.com/o2/a/cn10g50/0
âStep into Local Marketing Spotlight with Your Very Own Local Directory System & GPT-Powered Assistants.
Watch Business Owners Flock to Your Agency, Eager for Being Listed And Desperate for Marketing Services.â
Revolutionary Directory Platform for Unmatched Marketing Success.
Click Here For More Info : https://warriorplus.com/o2/a/cn10g50/0
We improve MOZ Domain authority 30+ in 15 Days its help to improve google rank, improve your website SEO, and you get traffic from google
DA - 0 to 30 - (Only $29) - Yes, Limited time !!
>> 100% Guarantee
>> Improve Ranking
>> White Hat Process
>> Permanent Work
>> 100% Manual Work
>> 0% Spam score increase
⥠From our work your website keyword get rank on google and get organic traffic from google through keywords
Contact now: intrug@gmail.com or Visit us Now : https://open247.chat/DA/
The crypto bull market is heating up, and nowâs the perfect time to grab your free Bitcoin.
Just yesterday, hundreds of members jumped at the chance to claim theirs. Have you claimed yours yet?
Hereâs the deal: You can get $10 in Bitcoin (BTC), completely free â no catch, no purchase necessary.
Just attend one of this weekâs exclusive workshops, immerse yourself in the knowledge, and complete a short quiz.
$10 in BTC will be sent straight to your crypto wallet.
Click Here For More Info : https://bit.ly/43e1oX8
Hi there,
I apologize for reaching out via your contact form, but I wasnât sure who the best point of contact is within your company. I wanted to introduce you to a valuable solution for dealerships looking to enhance their lot securityâmobile security trailers. Our security trailers are equipped with cutting-edge technology to provide 24/7 surveillance for all of your inventory. https://mrsecuritycameratrailers.com/ These trailers offer high-definition cameras, motion detection, and real-time alerts, all managed remotely for maximum convenience. They are designed to safeguard your property, prevent theft, and ensure the safety of your assets 24/7. Iâd love to share a testimonial from one of our dealership clients so you know we are the real thing and a trusted vendor in your industry. You can reach me at mailto:sales@mrsecuritycamera.com or 916-672-2660. If this isnât something your company is looking for right now, please feel free to let me know, and Iâll ensure we donât contact you again.
The crypto bull market is heating up, and nowâs the perfect time to grab your free Bitcoin.
Just yesterday, hundreds of members jumped at the chance to claim theirs. Have you claimed yours yet?
Hereâs the deal: You can get $10 in Bitcoin (BTC), completely free â no catch, no purchase necessary.
Just attend one of this weekâs exclusive workshops, immerse yourself in the knowledge, and complete a short quiz.
$10 in BTC will be sent straight to your crypto wallet.
Click Here For More Info : https://bit.ly/43e1oX8
Advantages of hiring a Developer:
Specialized Expertise
Tailored Customization and Control
Time and Cost Efficiency
Custom Plugin Development
SEO Optimization
Ongoing Support and Maintenance
Seamless Integration and Migration
Scalability for Business Growth
Hire a web developer now from us. Contact us at lisa365chat@gmail.com
Hi Mate,
"Traffic down, rankings down, revenue down, business down."
"Just as the new broad core update is rolling out, sales vanished while traffic is way up."
"We are free falling."
"Yes, looks like a drop. Ad revenue record low for November.â
"Big drop today. -40%."
"Yeah, a very big drop today. Seems like Google wants to ensure that they donât lose any piece of the Christmas shopping cake."
"Anyone else seeing big changes for their sites at the moment? Traffic for our Indonesian speaking main site is down by nearly 50%"
Well, Google, hit you hard again, didnât it?
If the above SEO chatter regarding the November 2024 Core Update hits a little too close to home then know thisâŚ
We stand by you.
We stand by you like always and are happy to report that we have massacred the Update of Google November 2024 Core Update.
As soon as the update hit the web, me and my team hit the SEO lab and started testing thousands of websites for various permutations and combinations.
AND THE RESULTS ARE ASTOUNDING!
We are happy to share the fruits of labour with you so your money site doesnât have to labour for revenue this Black Friday.
Come, take a bite at it. Contact me at seolinkfarms@gmail.com
Sam
seolinkfarms@gmail.com
Hello
I hope this message finds you well. My name is Mathew, and I am a Research Assistant in the Research and Development Department one of the leading biopharmaceutical company based in London, England. I am reaching out to explore a potential partnership opportunity.
We are currently seeking a reliable business representative in your region to assist us in sourcing essential raw materials used in the production of high-quality antiviral vaccines, cancer treatments, and other life-saving pharmaceutical products. While this may be outside of your primary area of expertise, it offers a unique opportunity to diversify your business interests and generate additional income.
Our company has been actively searching for a reputable supplier but has yet to establish a direct source.
However, I have identified a local supplier who offers the necessary materials at a significantly lower cost compared to our previous purchases. This could present a mutually beneficial opportunity for both parties.
If you are interested in learning more about the profit structure and the specifics of this potential collaboration, please feel free to reach out.
I would be happy to provide additional details at your convenience.
Thank you for considering this partnership, and I look forward to your response.
Mathew Lundgren
Research & Dev Dept
Email: mathew@mathewlundgren.com
Advantages of hiring a Developer:
Specialized Expertise
Tailored Customization and Control
Time and Cost Efficiency
Custom Plugin Development
SEO Optimization
Ongoing Support and Maintenance
Seamless Integration and Migration
Scalability for Business Growth
Hire a web developer now from us. Contact us at lisa365chat@gmail.com
Are you looking for Web design/ Development for your business? contact us at t3.technology@outlook.com
Iâm reaching out because I know the right PR, SEO, and marketing strategies can skyrocket a brandâs growth.
Since 2010, our team has been working with businesses to get them featured in major outlets like USA Today, Forbes, and Sports Illustrated. We know what it takes to craft the perfect pitch and target the right journalists.
Hereâs what we can do for you:
Public Relations: Secure press coverage in top outlets.
SEO: Rank higher on search engines to attract more customers.
Social Media: Grow your brandâs following and engagement.
PPC Ads: Generate high-quality leads with optimized campaigns.
Web Design: Build a website that turns visitors into clients.
If youâre ready to elevate your brand, letâs chat. Iâd be happy to show you some of the results weâve achieved for other companies.
Looking forward to connecting! Just send me a reply here
We improve MOZ Domain authority 30+ in 25 Days its help to improve google rank, improve your website SEO, and you get traffic from google
DA - 0 to 30 - (Only $29) - Yes, Limited time !!
>> 100% Guarantee
>> Improve Ranking
>> White Hat Process
>> Permanent Work
>> 100% Manual Work
>> 0% Spam score increase
⥠From our work your website keyword get rank on google and get organic traffic from google through keywords
Contact now: intrug@gmail.com
127 Queen St W, Apt 332
Toronto, ON M5H 4G1, Canada
Tel: +1 437 888 3824
Email: tomlawman@opayq.com
tomlawman@ptct.net
Toronto, February 25, 2025
Dear Sir/Madam,
I am Attorney Tom Lawman, principal partner at Tom Lawman Law LLP. I am reaching out with a confidential opportunity regarding an unclaimed permanent life insurance policy valued at US$11,500,000.00. This policy belonged to our late client, who passed away in Canada four years ago. Despite our best efforts, no family member has come forward to claim the benefit, and according to the insurance company, unclaimed policies will revert to the state after five years.
Because you share the surname, I propose that we partner to claim this benefit. With your consent to add your name as next of kin, the proceeds will be processed on your behalf, with 90% divided equally between us and 10% donated to charity. This arrangement is completely risk-free and can be finalized within approximately 15 days once you agree.
If you are interested and would like further details and documentation, please contact me at the above telephone number or via email.
Sincerely,
Tom Lawman Esq.
Attorney at Law
Hi,
I am a senior web developer, highly skilled and with 10+ years of collective web design and development experience, I work in one of the best web development company.
My hourly rate is $8
My expertise includes:
Website design - custom mockups and template designs
Website design and development - theme development, backend customisation
Responsive website - on all screen sizes and devices
Plugins and Extensions Development
Website speed optimisation and SEO on-page optimisation
Website security
Website migration, support and maintenance
If you have a question or requirement to discuss, I would love to help and further discuss it. Please email me at e.solus@gmail.com
Regards,
Sachin
hireadevelopernow@gmail.com
Hey there,
I came across your website, and while it looks great, your logo doesnât quite match your brandâs vibe.
First impressions matter, a quick update could make a huge difference.
I design logos that align perfectly with your brand.
Want me to take a look?
Check out my work here: https://bit.ly/david-projects
David
With Orbit Explainers, you can make a memorable impression on your clients and target audience with a professional logo animation to elevate your brand. Bringing your logo to life through animation makes it more engaging and impactful for viewers. For just $99, transform your static logo into an animated logo, a dynamic visual that grabs attention, enhances storytelling, and strengthens brand recognition. An animated logo adds professionalism and leaves a lasting impression, perfect for websites, social media, video intros, email signature presentation, and more.
Explore our portfolio & chat with us at www.orbitexplainers.net. Or email us at ellen@orbitexplainers.net and Call me to discuss (332) 222-4058
Letâs create something amazing together.
Immediate attention needed
Hey there,
I came across your website, and while it looks great, your logo doesnât quite match your brandâs vibe.
First impressions matter, a quick update could make a huge difference.
I design logos that align perfectly with your brand.
Want me to take a look?
Check out my work here:https://bit.ly/projects-kassou
Kassou
Immediate attention needed
Hey there,
I came across your website, and while it looks great, your logo doesnât quite match your brandâs vibe.
First impressions matter, a quick update could make a huge difference.
I design logos that align perfectly with your brand.
Want me to take a look?
Check out my work here:https://bit.ly/projects-kassou
Kassou
Website not ranking? Get your Free SEO Audit nowâuncover hidden issues fast! Limited spotsâclaim yours before midnight tonight and skyrocket your rankings. Click here to start! https://hireseogeek.com/audit.html?src=przeglad-urologiczny.pl
Dear Business Owner,
Are you frequently traveling for business?
Many freelancers still spend unnecessarily high amounts on roaming fees.
We offer a smart solution with international eSIM plans â no physical SIM card needed, ready in minutes, and with savings of up to 85%.
Great for digital nomads.
Learn more: https://e-simworldwide.com
Kind regards,
e-SIM Worldwide
Hey there,
I came across your website, and while it looks great, your logo doesnât quite match your brandâs vibe.
First impressions matter, a quick update could make a huge difference.
I design logos that align perfectly with your brand.
Want me to take a look?
Check out my work here: https://bit.ly/projects-kassou
kassou
Hey there,
I came across your website, and while it looks great, your logo doesnât quite match your brandâs vibe.
First impressions matter, a quick update could make a huge difference.
I design logos that align perfectly with your brand.
Want me to take a look?
Check out my work here: https://bit.ly/projects-kassou
kassou
Hi,
I am a senior web developer, highly skilled and with 10+ years of collective web design and development experience, I work in one of the best web development company.
My hourly rate is $8
My expertise includes:
Website design - custom mockups and template designs
Website design and development - theme development, backend customisation
Responsive website - on all screen sizes and devices
Plugins and Extensions Development
Website speed optimisation and SEO on-page optimisation
Website security
Website migration, support and maintenance
If you have a question or requirement to discuss, I would love to help and further discuss it. Please email me at e.solus@gmail.com
Regards,
Sachin
hireadeveloper.now@gmail.com
Hey there,
I came across your website, and while it looks great, itâs not showing up where it should on Google. A few SEO fixes like speeding up the site, adding meta tags, and improving keyword focus could make a big difference in traffic and leads.
I offer monthly SEO that helps businesses grow steadily. Want me to take a look?
Check out my work here: https://bit.ly/jacob-projects
Best,
Jacob
Unlock Natural Energy, Vitality & Sexual Wellness with Pure Maca Root
Discover the power of Organic Peruvian Maca, a time-honored superfood from the Andes, known for enhancing vitality, boosting libido, and supporting physical endurance. Our pure, gelatinized, non-GMO formula ensures optimal digestion and absorption, making it the perfect choice for your health journey.
Maca is celebrated for:
â
Enhancing Libido & Sexual Function â Natural compounds promote desire and performance
â
Supporting Erectile Function â Studies suggest improvement in ED symptoms over time
â
Boosting Energy & Endurance â A natural way to enhance stamina and physical strength
â
Improving Mood & Cognitive Function â Helps combat stress, anxiety, and mental fatigue
â
Packed with Antioxidants & Essential Nutrients â Supporting overall health & wellness
Our heat-processed maca ensures maximum digestibility, reducing potential discomfortâperfect for sensitive stomachs.
Limited-Time Offer: Get your bottle now for ONLY $25!
Take the step toward a healthier, more energized you.
Click below to order today!
https://primemaca.shop/
Best regards,
Elaine
Hello
przeglad-urologiczny.pl
Weâve not spoken prior to this, I hope youâre alright with this approach.
Growing your social media presence with followers, likes, subscribers, and views makes your brand seem more reputable, boosting customer trust.
- https://facebook.com/wowitloveithaveit
- https://www.instagram.com/dankdollz_mag
- Linkedin
- https://x.com/DankDollz
- https://www.youtube.com/channel/UCIG1d4Ci6nThd5vjIv__xRw
Growing fast on social media often means starting with bought likes, views, and followers.
Weâve earned 1.4 million+ customersâ trust.
Enroll without delay right here : https://t.ly/growwithbuzz.ai
Are you still looking at getting your website done/ completed? Contact e.solus@gmail.com
Struggling to rank on Google? Our SEO experts can help. Contact es.olus@gmail.com
I hope this message finds you well and thriving! Iâm thrilled to share some exciting news that
will redefine how you approach local marketing. Introducing Local Directory Fortune â City Stars,
the ultimate solution for building and managing a professional local directory effortlessly.
We all know the challenges of standing out in the crowded local business space, but this is more than just
another tool â itâs your opportunity to become the go-to resource for businesses and customers in your community.
Click Here For More Info : https://warriorplus.com/o2/a/cn10g50/0
Hey there przeglad-urologiczny.pl
I hope you are okay with me reaching out â I pen articles for for small to medium enterprises.
You can use them on przeglad-urologiczny.pl to increase your search engine ranking, or post them on your social media.
Iâm transparent about what I charge.
Letâs chat about possible projects, Hire me on https://t.ly/fasttrackhire.professional
Iâve proudly written marketing blogs serving diverse fields, spanning health & wellness, banking & finance, schools and universities, hospitality and travel, engineering sectors, the tech space, as well as the IT sector and more.
I developed organic traffic-focused articles and social platform blogs as part of a project for a client who markets weight loss supplements https://t.ly/profit.healthcare
When you have a chance, review a few samples and put me on the project.
Hey there,
I came across your website, and while it looks great, your Logo doesnât fully reflect the strength and potential of your business. A fresh, modern logo could make a powerful first impression and help you stand out.
I design bold, timeless identities that truly connect. Want me to take a look?
Check out my work here: https://rebrand.ly/projects-Anabella
Anabella
Hi,
Greetings of the day!
Can we help you with 3D Rendering?
We are a 3D Architectural Visualization company from India and we have a team of 8 dedicated people.
We completed the project with the tightest deadline. The project can be anything like Residential, Commercial, High rise Urban Planning, etc
Our starting range is $100-$200.
Reply "Yes" to this Email to get FREE quote.
or
you can schedule a meeting at your convenience using this link: https://calendly.com/flyingvertex/30min
Best Regards,
Rahul Mehra
3D Visualizer
I hope this message finds you well.
My name is Jeremy Allen, representing BNF Investments LLC, a Florida-based investment firm. We are currently expanding our operations beyond the United States and are seeking to collaborate with established and reputable business owners operating internationally.
If your business is in need of expansion financing or investment support, we would be pleased to explore potential opportunities to assist with timely and strategic funding.
Should this be of interest, kindly contact me at your convenience via email: ja@bnfinvestmentsllc.com
Yours sincerely,
Jeremy Allen
BNF Investments LLC
ja@bnfinvestmentsllc.com
Hello,
Little-known gum hack heals gum tissue effortlessly. Users are already enjoying powerful results.
Click to this page --> take control of your dental strength without side effects https://t.ly/FreshNourish.FIT
Hi,
Skyrocket your ad returns with ROI-focused social media traffic strategies, fully executed by Sarah.
See the details and hit your goals faster ---> https://t.ly/GrowthClicks.expert
Hi there!
Supercharge the bodyâs life force, Supercharge your mitochondria with a doctor-formulated energy blend with this advanced cell energizer.
Learn more to revive your strength --- https://t.ly/VitalRise.health
Increase your local search results with our trusted backlink and citation method.
Check the process on our site =>> https://t.ly/BacklinkPro.pro
Dear Sir/Madam,
Do you want to become a vendor/supplier/service provider of Delta Air Lines, Inc.? We are looking for a reliable, innovative and fair partner for 2025/2026 series tender projects, tasks and contracts. Kindly indicate your interest by requesting a pre-qualification questionnaire. With this information, we will analyze whether you meet the minimum requirements to collaborate with us.
Best regards,
Carey Richardson
V.P. - Corporate Audit and Enterprise Risk Management
Delta Air Lines Inc
Group Procurement & Contracts Center
1030 Delta Boulevard,
Atlanta, GA 30354-1989
United States
+1(470) 982-2456
Hi przeglad-urologiczny.pl,
Did you know that slow-loading websites lose visitors within seconds? A poor PageSpeed score not only hurts user experience but also affects your SEO rankings and conversion rates.
Letâs fix that.
Click the link below to instantly check your websiteâs speed (both desktop and mobile):
Check Your PageSpeed Now https://pagespeed.web.dev/analysis?url=przeglad-urologiczny.pl
Please note: The report may take a moment to load â hang tight while Google runs the test. Itâs worth the wait!
IMPORTANT NOTE: You have to wait for 2 minutes for the report
If your score is below 60, weâre offering a complete optimization service for just $75. This includes:
>> Advanced speed tuning (desktop & mobile)
>> Image compression & lazy loading
>> Code optimization (HTML, CSS, JS)
>> Better Core Web Vitals
>> Faster load times = Happier visitors & better SEO
Act now and turn those slow scores into lightning-fast performance.
https://pagespeed.web.dev/analysis?url=przeglad-urologiczny.pl
Speed is money. Donât let a slow site cost you.
Contact us Now at intrug@gmail.com
Hello,
Build a second side income just by posting authentic reviews during quiet times â no tools required.
Sign up today to get rewarded today -> https://t.ly/workview.PaidtoWriteReviews
Hi, I represent an SEO company that specialises in getting you AI citations and higher rankings on Google.
Iâd like to offer you a 100% free SEO audit for your website. Would you be interested?
Hi there,
Just imagine: what if 45 seconds each day could align you with strategic growth â both in your role and in life.
It could be that God is already inviting you to pause â and this could be the shift youâve been seeking.
These are the kinds of changes happening:
- Visible results that eliminate any lingering barrier youâve faced.
- Peace around money that removes any strain youâve worked under.
One divinely inspired approach is impacting futures every day.
Accept the invitation, and receive abundant clarity today https://t.ly/peacevision.church
Hey there,
Are you even struggling with workflows shooting content for reels during content cycles?
This AI-powered platform handles everything by automating typed input into on-brand presentationsâno editing hassle.
Designed for organizations, it helps scale content without technical skills.
Deliver onboarding content in minutes.
Test it yourselfâno downloads required > https://t.ly/RecordGen.Video
Hello,
Przeglad Urologiczny -- Find out how successful founders rely on to reduce midsection weight, without sacrificing productivity.
Check it out to learn the proven method >> https://t.ly/TopClearGuide.BlogTips
Edmund Blackston
Hi Przeglad Urologiczny,
What if you could generate steady returns by using any unused unneeded internet access?
Enable earnings instantly and and without effort transform that unused broadband connection into a new income stream with your business running as usual
Backed by over 345,000 loyal users > https://t.ly/monthly-data-money.ai
Have you experienced loss or trauma? Losing people we love is a part of human life, and it is inevitable. Our brains can get stuck in trying to process such deep emotional loss. When the brain is stimulated into an REM (Rapid Eye Movement) state, it is many times more effective at processing trauma. Loss of spouse, loss of child, loss of parent, loss of pregnancy, loss of health, loss of safety, all these and more can be overcome.
Whether your trauma is in the past, or you want to be prepared for a future loss, the following links will take you to more information about the hour long program that can stimulate your brain into an REM state. It downloads at https://se-rem.com/. www.facebook.com/SelfEffectiveREM or https://www.trustpilot.com/ (search for https://se-rem.com/).
Thanks,
David B.
https://se-rem.com/
Przeglad Urologiczny Hello!
Ever think about whatâs really on the other end of that random number?
Try it in under 30 secondsânothing to install.
205,000+ clients rely on our expertise -- https://t.ly/phonedeviceping.com
Danuta Esteban
Hi Przeglad Urologiczny,
Is it worth exploring an effortless way to generate supplemental returns by leveraging the existing wasted internet potential?
Get going today to and seamlessly transform that unused broadband connection into a new income stream with no disruption
We proudly serve 535,000+ users globally >> https://t.ly/data-monetization.ai
Hello,
At Cateus Investment Company (CIC), we understand that the right funding structure can significantly accelerate your business growth. Whether youâre an early-stage startup or a scaling enterprise, our investment solutions are tailored to align with your vision and long-term success.
We currently offer two primary financing options:
⢠Debt Financing: Access capital at a competitive 3% annual interest rate, with no prepayment penaltiesâideal for businesses seeking straightforward, low-cost funding while maintaining full ownership.
⢠Convertible Debt Financing: A hybrid solution offering 3% annual interest with a conversion feature. After two years, the debt can convert into a 10â15% equity stake, providing both immediate funding and future alignment of interests.
If youâre seeking strategic funding with flexibility, we invite you to share your pitch deck or executive summary. Our team is ready to work with you to identify the most effective investment structure to support your business trajectory.
We look forward to exploring how CIC can partner with you to unlock your companyâs full potential.
Warm regards,
Oman Rook
Executive Investment Consultant | Director
Cateus Investment Company (CIC)
oman-rook@cateusgroup.org | cateusgroup@gmail.com
www.cateusinvestmentsgroup.com
Hi, would you like to be affiliates of our red light therapy caps?
We are FDA cleared and would love to offer you great affiliate comissions! here is the website: www.Growellcap.com
Reply to my email or book a call to talk: https://calendly.com/calldanield/15-minute-phone-call?
Best regards,
Daniel
Dear Founder,
An active investor we represent is now reviewing investment ready business ideas across all sectors no matter your industry or stage. What matters most is a compelling, scalable idea with strong execution potential.
Available Funding Options:
⢠3% annual interest rate
⢠No early repayment penalties
⢠Convertible loan option available â convert to 10â15% equity after 2 years (optional)
Whether youâre building the next big tech platform, expanding a niche brand, or launching a bold new venture, nowâs your chance to access smart capital on founder-friendly terms.
Simply send in your pitch deck or business plan to start the conversation. If your idea is solid, weâre ready to move.
Letâs help you bring your vision to life.
Yours Truly,
Chary Marshal
Investment Consultant/Strategist
Email: charyl74@akirapowered.com
Hey there,
I came across your website the content is great, but the logo doesnât match the level of what youâre offering. A clean, modern logo makes a big first impression.
I design logos that feel right for your brand. One client said it helped them get more clicks and trust.
Want me to take a quick look?
check out my work here: https://bit.ly/projects-tina
Tina
Hello there Przeglad Urologiczny,
regards >> https://facebook.com/wowitloveithaveit
I checked out your online presence and noticed a strong focus.
Do you feel your presence could generate more leads or sales?
Many business owners are seeing stronger results by bringing in a proven expert - freeing up time in the process.
Check what expert help can do >> See how it works: https://t.ly/BuzzAdStream.io
Darryl Sandes
Discover a variety of digital products including ebooks, templates, videos, and more! Perfect for business, learning, or fun.
Browse now at janestrinketonline.com - your ideas start here!
Get high-accuracy crypto signals for just $8/month, with a money-back guarantee and live WhatsApp chat support. Along with the signals, you will also receive crypto market updates, insider news, crypto stories, and access to BTC magazine. We offer our own web portal, as well as Android and iOS mobile apps.
Visit our Website: https://bullcryptosignals.com
Download our Mobile App: https://bullcryptosignals.com/mobile
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||